理论上讲,只要电极电势足够低,任何金属离子都有可能在电极上还原或电沉积。但是,有可能金属离子的还原电势比溶剂的还原电势更低,则在金属还原之前就会发生溶剂的还原。因此,必须对金属的阴极还原的可能性进行分析。
在元素周期表中,金属基本上按照活泼性顺序排列。因此,可以利用元素周期表来大致说明实现金属离子阴极还原的可能性。元素周期表与金属电沉积的可能性见表2-1。一般来说,若金属在周期表中的位置越靠左,它们在电极上还原及电沉积的可能性就越小;反之,若金属在周期表中的位置越靠右,则这些金属就越容易实现。在水溶液中大致可以铬分族为分界线,位于铬分族左方的金属元素不能在电极上电沉积,铬分族中的诸元素中除铬能较容易地自水溶液中电沉积出来外,钨、钼的电沉积都极其困难(但还是有可能的);位于铬分族右边的金属都能较容易地自水溶液中电沉积出来。
表2-1 元素周期表与金属电沉积的可能性
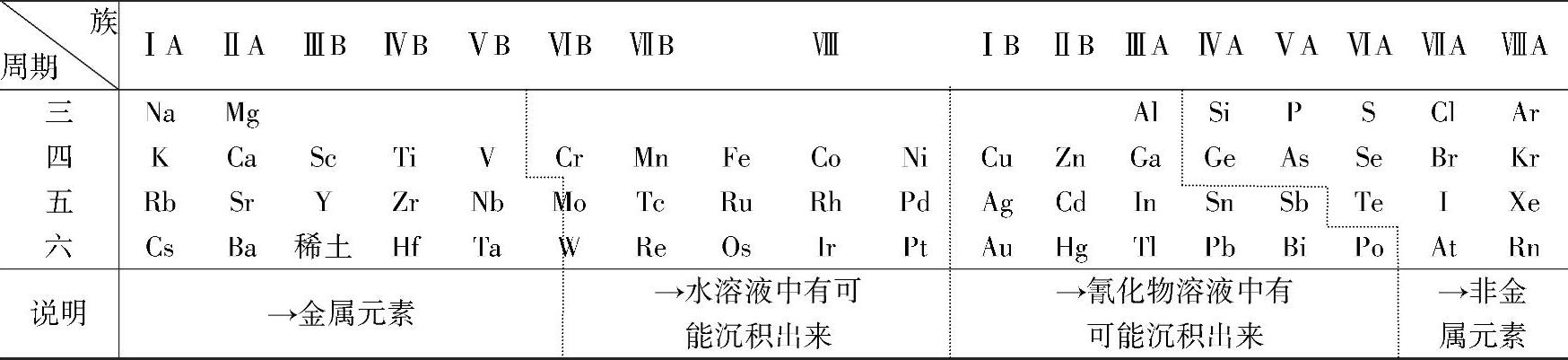
这种划分方法主要是根据实验确定的。影响分界线位置的因素中,既包括热力学因素,也包括动力学因素。例如,若只考虑热力学数据,则水溶液中Ti2+、V2+等离子的电沉积过程还是可能实现的。(https://www.xing528.com)
这里需要着重指出,若涉及的电极过程不是简单金属离子在同种电极基底上以纯金属形式析出,则“分界线”的位置可能有很大的变化,可能会出现下列几种情况:
1)若金属电极过程的还原产物不是纯金属而是合金,则反应产物中金属的活度比纯金属小,因而有利于还原反应的实现。最明显的例子是,若用汞作为阴极,则在水溶液中碱金属、碱土金属和稀土金属离子都能在电极上还原而生成相应的汞齐。我们还经常观察到,在异种金属表面上,可在比平衡电极电势更高的电势下沉积出单原子层以下厚度的金属层,这种现象称为“欠电势沉积”。
2)若溶液中金属离子以比简单水化离子更稳定的配位离子形式存在,则为了实现还原反应就必须由外界供给更多的能量,因而体系的平衡电极电势变得更低。这显然会使金属析出更加困难。例如,在氰化物溶液中,只有铜分族元素及在周期表中位于铜分族右方的金属元素才能在电极上析出,即分界线的位置向右方移动。在含有其他配位剂的溶液中,也可以观察到类似的现象。在含有不同配位剂的溶液中,金属的活泼性顺序不完全相同。一般来说,若金属离子的外电子层中存在空的(n-1)d轨道,而且在形成配位离子时被用来组成杂化轨道,则所形成的配位离子一般稳定性比较高,它们在电极上也就不容易析出。这就说明了为什么过渡族元素往往容易生成稳定性较高且不易在电极上析出的配位离子。
3)在非水溶剂中,金属离子的溶剂化能可能与水化能相差很大。因此,在各种非水溶剂中,金属的活泼性顺序可能与水溶液中有很大不同。此外,各种溶剂的分解电势也各不相同。因此,某些于水溶液中不能在电极上析出的金属元素可以在适当的有机溶剂中电沉积出来。例如,Li、Al、Mg等金属不能自水溶液中电沉积出来,但可以从适当的有机溶剂、离子液体中电沉积出来。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




