智能高分子可因外界环境的微小改变而引起相对大且剧烈的物理或化学变化。这类聚合物可以识别外界的信号,并且判断信号的大小,从而做出直接的响应。许多刺激(物)都可以调节聚合物的响应性,典型的有温度、pH、生物活性分子、磁场、电场和超声波等。这些刺激可以分为物理性刺激和化学性刺激,不只局限于体内信号,还包括外界信号。化学性刺激(例如pH、离子因素等)可以在分子水平上改变聚合物链间的相互作用,或者改变聚合物和溶剂之间的相互作用;物理性刺激(例如温度、磁场等)会在某一临界点时改变分子间的作用。有些高分子刺激响应系统结合了两种或更多种的刺激-响应机制,例如温度响应性高分子也可以因为pH的改变而有所响应,这种将两种或多种刺激信号同时应用在一种聚合物中的系统,叫作多重响应聚合物系统。聚合物的响应行为也是多样的,如沉淀、溶解、降解、溶胀、坍塌、形状变化、构象变化等。目前,刺激响应性的智能药物释放体系有以下几大类,见表6.2.7。
表6.2.7 智能药物释放体系分类表
续表
1.温度响应性
在某一温度下,聚合物及其溶液发生不连续的相转变,该温度即为临界溶解温度(Critical Solution Temperature,CST)。如果聚合物溶液在较低温度下为均一相,而在达到或高于某一温度时出现相分离,该温度通常称为较低临界溶解温度(Lower Critical Solution Temperature.LCST)。
(1)很多具有LCST的高聚物都具有温度响应相变性质,其中聚(N-取代丙烯酰胺) (PNIPAAm)的研究最多。
(2)基于两亲性平衡的聚合物也具有温度响应性胶束化能力,在高于临界凝胶温度(Critical Gelation Temperature,CGT)时形成水凝胶。
(3)一些生物高分子如明胶、琼脂、结冷胶苄酯等,温度降低时可以从无规线团变成螺旋结构,在构象变化中发生分子间的物理交联而凝胶化,属于温度响应性高分子。
(4)采用具有LCST的热敏高分子与脂质体连接而制备的热敏脂质体也具有热响应性功能,在LCST附近时,热敏高分子会发生亲水-疏水性的变化,从而使脂质体的稳定性可以由温度来控制,脂质体内容物的释放也呈现出温度敏感性,并且其表面性质也随温度的变化而变化。
2.pH响应性
pH响应性高分子有可电离的基团,随着环境pH的变化而失去或获得质子,是高分子上所带净电荷的快速变化导致了高分子链流体力学体积的改变。pH响应性高分子大致分为聚酸、聚碱和pH响应可降解聚合物等。
在聚酸中,pKa为5~6的含有羧基的聚酸最有代表性,如聚丙烯酸(PAAc)和聚甲基丙烯酸(PMAA),在中性和碱性环境下失去质子带负电荷,高分子链间产生静电斥力。在低pH下获得质子使静电斥力消失,疏水作用起主导作用,使得在水性环境中聚合物链发生聚集。
聚碱在中性或酸性条件下离子化带正电荷,而在碱性条件下释放质子。典型的聚碱有聚-4-乙烯吡啶、聚-2-乙烯吡啶啶(PVP)和聚甲基丙烯酸N,N-二甲基氨基乙酯(PDMAEMA)等。
pH响应可降解聚合物的典型代表是聚原酸酯,它在温和的酸性环境中快速降解,而在生理pH下相对稳定。将乙交酯引入高分子链中,乙交酯水解产生羧基,从而催化原酸酯键的断裂而导致自催化降解。
3.葡萄糖响应性(https://www.xing528.com)
糖尿病患者需要通过周期性的胰岛素给药来调控血糖。葡萄糖响应水凝胶系统可以根据血液中的葡萄糖浓度进行胰岛素的自我调控释放,将血液中的胰岛素调控到正常水平。实现这一目标需要利用到pH响应性高分子材料[如甲基丙烯酸N,N-二甲基氨基乙酯(DMAEMA)]、葡萄糖氧化酶和过氧化氢酶。当过量的葡萄糖扩散到水凝胶中时,葡萄糖氧化酶就会催化葡萄糖形成葡糖酸,葡糖酸降低了水凝胶网中的pH,增大了静电斥力而导致水凝胶溶胀。溶胀的水凝胶体积变大,使得凝胶网空隙变大,促进胰岛素的释放。体系中的过氧化氢酶将过氧化氢转化为氧气,进而氧化葡萄糖,并减少过氧化氢对于葡萄糖氧化酶的抑制作用。
4.场响应体系
(1)力场。骨、肌肉和血管等组织存在于动态的力学环境中,它们的细胞外基质可视为各种生长因子的储存器,受到力学刺激时将因子释放至周围组织中的细胞周围,调控很多生理过程,如释放血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)可特异促进组织脉管形成。
(2)磁场。生物相容性超顺磁纳米粒已广泛用于药物的靶向释放微载体,在外加磁场作用下,将载体定向于靶区,使其所含药物定位释放,提高靶部位药物浓度,降低对人体正常组织的副作用。如胰岛素的磁响应海藻酸盐微球,在外加磁场作用下胰岛素较快释放。随磁场作用增大,胰岛素从磁响应海藻酸盐微球中释放加快。磁场反复作用会导致这种增大效应的降低。高分子交联密度增大、海藻酸盐微球刚性增大可使胰岛素释放速度降低。
(3)电场。电场敏感药物释放体系是通过电化学法来控制药物释放的体系。在该体系中,药物包埋于高分子聚合物载体中,在电信号刺激下,高分子聚合物载体结构发生变化,从而进行药物的控制释放。例如采用离子渗透原理的经皮给药系统,将电场作用于膜或溶质,可以调节溶质透膜的通量。电场对带电荷溶质及其反离子的作用,引起溶质在水化膜内的电泳迁移。
5.其他
(1)抗原响应性。将抗原和相应的抗体固定在半互穿网络上,可得到抗原响应性高分子网络。高分子网络上的抗体与游离抗原的亲和常数大于与网络连接的抗原。游离抗原的存在会破坏连接在高分子网络上的抗原与抗体间的作用,引起水凝胶溶胀。这种抗原响应性可以用于药物的输送体系。
(2)凝血酶响应性。经皮冠状动脉腔内血管成形术(Percutaneous Transluminal Coronary Angioplasty,PTCA)的患者大多动脉会发生再狭窄,而植入支架患者的一小部分也会发生动脉再狭窄。经PTCA手术后,将抗增生剂局部释放至动脉是解决再狭窄的有效办法。有研究合成了酶降解交联剂,用其构筑了心血管支架信号响应药物释放涂层。凝血酶随血管壁受损会刺激平滑肌细胞增殖,据此合成了可以被凝血酶降解的肽交联剂,并形成凝胶,观察药物的释放特性。
(3)超声波响应性。利用超声波可以调控药物的释放行为。超声波可使高分子溶蚀加快,药物释放速度增大。生物溶蚀性或非溶蚀性高分子均可作为药物载体。高分子体系对于超声波的响应很快(2分钟内),且具有可逆性。药物释放速度增大的程度与超声波的强度、频率和作用周期有关。这种影响可能是由气穴现象或声波波动引起的。在脱气的缓冲溶液(使气穴效应最小化)中,药物的释放速度会小很多。
(4)原位形成药物输送高分子系统。原位形成药物输送高分子系统是以液体形式经皮下注射到体内或进入腔道后,在给药部位转变成固体或半固体的一种给药系统。与普通植入剂相比,这种给药方式可以减少病人的伤害和痛苦,不需要进行局麻和外科手术,可延长药物的释放时间。基于在给药部位形成固体或半固体装置的机制,可将其分为热塑性糊剂、原位交联高分子系统、原位高分子沉淀和热诱导凝胶系统。
(5)光响应性。光响应性聚合物分子内通常含有对光敏感的基团,当受到光刺激时,凝胶网络中的光敏感基团可发生光异构化或光解离,引起基团构象和偶极矩变化,使凝胶溶胀而控制药物释放。
(6)盐响应性。盐敏感性水凝胶指在外加盐的作用下,凝胶的溶胀率或吸水性发生突跃性变化,这类水凝胶的正负带电基团位于分子链的同一侧基上,两者可发生分子内和分子间的缔合作用。盐敏感性水凝胶一般由甜菜碱两性单体共聚交联而成,其在盐溶液中的溶胀行为呈现反聚电解质行为,即溶胀比随外加盐浓度的增加而增加。
[1]1kDa=1 000摩尔质量。k Da也简称为kD,1D=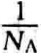 g,NA为阿伏加德罗常数。
g,NA为阿伏加德罗常数。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




