(一)漂液的制备
1.氯水及次氯酸盐漂液的制备
化学反应:氯气通入水中产生下列反应:
Cl2+H2O →HClO+HCl
反应的平衡常数随温度增加而增加,当温度在25℃以下,溶液的pH小于2时,溶液中的氯主要是以分子状态存在。氯气通入碱性溶液中,可制备不同盐基的次氯酸盐。如:
2Cl2+2Ca(OH)2→Ca(OCl)2+CaCl2+2H2O
2Cl2+2NaOH →NaOCl+NaCl+H2O
2.二氧化氯漂液的制备
二氧化氯为非常活泼和不稳定的气体,处于气态或凝聚态时具有爆炸性,其沸点为10℃。二氧化氯易溶于水,其水溶液在低温和暗处比较稳定,纸浆漂白试验用其水溶液作为漂剂。二氧化氯漂液是由氯化钠、氯酸钠与硫酸反应或由亚氯酸钠和硫酸反应产生二氧化氯,用水吸收来制备。其反应按下式进行:
NaClO3+NaCl+H2SO4→ClO2+1/2Cl2+Na2SO4+H2O
2NaClO2+H2SO4→2HClO2+Na2SO4
8HClO2→6ClO2+Cl2+4H2O
3.过氧化氢漂液的制备
市售过氧化氢溶液一般含量在30%以上,呈酸性,使用前根据漂白浆浓度和试剂用量,加入蒸馏水适当稀释后制备成漂液,置于棕色试剂瓶中,放于阴凉暗处备用。
4.臭氧的制备
产生臭氧的方式有很多,其中无声放电法较为简单,可获得大量低浓度臭氧供使用。臭氧发生器的主要元件是放电管,有一对用绝缘体分开的金属电极。在一对高压交流电极之间通过空气(或氧气)时,由于气体粒子的电离而产生电子,这些电子从电场中获得能量,根据电子碰撞能量的大小,氧分子可以被激励或分解成原子,然后在氧原子和氧分子及第三个分子(氮或氧)的三体碰撞中形成臭氧,用下式表示:
3O2+e →2O3
(二)漂液的分析
漂液分析是漂液制备的一项质量检查,关系到纸浆漂白工艺过程参数能否准确控制,对漂白浆的质量及漂白的经济效益均有直接关系。
1.氯水及次氯酸盐漂液中有效氯的测定
(1)测定原理
测定次氯酸盐漂液通常采用碘量法,也可用亚砷酸钠法。最常用的碘量法利用氯及氯的化合物在酸性溶液中,能与碘化钾发生氧化作用,游离出碘,而后用硫代硫酸钠标准溶液滴定,即可求出有效氯含量。一个分子的有效氯释放出一个分子的碘,即:
Cl2+2I-═══2Cl-+I2
测定不同含氯漂液时,可采用不同的酸性介质酸化:
醋酸酸化:
OCl-+2I-+2H+═══Cl-+I2+H2O
稀硫酸酸化:
ClO-2+4I-+4H+═══Cl-+2I2+2H2O
浓硫酸酸化:
ClO-3+6I-+6H+═══Cl-+3I2+3H2O
(2)仪器与试剂
a.250mL锥形瓶;b.50mL棕色滴定管;c.0.1mol/L硫代硫酸钠标准溶液;d.100g/L碘化钾溶液;e.20%醋酸溶液;f.5g/L淀粉指示剂。
(3)测定步骤
用移液管吸取5mL漂液(次氯酸钠取2mL)于盛有约45mL蒸馏水的250mL锥形瓶中,加入10mL 100g/L碘化钾溶液及20mL 20%醋酸溶液,使溶液呈酸性,用0.1mol/L硫代硫酸钠标准溶液滴定至浅黄色时,再加入5g/L淀粉指示剂2~3mL,继续滴定至蓝色刚好消失为止。
(4)结果计算
式中 ρ有效氯——有效氯含量,g/L
V——滴定时所耗用的硫代硫酸钠标准溶液的量,mL
c——硫代硫酸钠标准溶液的浓度,mol/L
0.0335——与1mmol的硫代硫酸钠相当的有效氯量,g/mmol
5——漂液体积,mL
(5)注意事项
① 取样时为了避免漂液中有效氯损失,移液管的端部应插入锥形瓶中液面以下放出试样。
② 测定氯水中的有效氯含量时,锥形瓶中的稀释用水应增至100mL。
③ 加入醋酸酸化时,醋酸量要足够,否则滴定达终点时有返色现象。
2.氯水及次氯酸盐漂液中有效氯的测定
(1)测定原理
在中性或微碱性时(p H=8左右),含氯的二氧化氯水溶液氧化KI,生成碘和亚氯酸钾。反应式如下:
用硫代硫酸钠标准溶液滴定上述反应析出的碘至终点,记下消耗的硫代硫酸钠标准溶液的体积为V1mL,随后用硫酸酸化至pH=3,则有反应中所产生的KClO2(亚氯酸钾),又与KI进行下面的反应:
设第二次滴定按(3)式析出的碘所消耗硫代硫酸钠标准溶液的体积为V2mL,则可分别计算出Cl2和ClO2的含量。(https://www.xing528.com)
(2)仪器与试剂
a.250mL锥形瓶;b.50mL滴定管;c.5mL移液管;d.0.1mol/L硫代硫酸钠标准溶液;e.100g/L碘化钾溶液;f.2moL/L硫酸溶液;g.5g/L淀粉指示剂;h.钼酸铵饱和溶液。
(3)测定步骤
在250mL锥形瓶中加入蒸馏水50mL及100g/L碘化钾溶液25mL,用移液管吸取5mL二氧化氯水溶液放入锥形瓶中(移液管端部应伸入液面以下)。用0.1mol/L硫代硫酸钠标准溶液滴定至浅黄色后,加入1mL淀粉溶液,继续滴定至蓝色刚好消失,记下消耗的硫代硫酸钠标准溶液量为V1mL。接着往溶液中加入5mL 2mol/L硫酸溶液,继续用0.1mol/L硫代硫酸钠标准溶液滴定,滴至浅黄色时加入淀粉指示剂,继续滴定至蓝色刚好消失,第二次滴定消耗的硫代硫酸钠标准溶液量为V2mL。
(4)结果计算
式中 V1——加酸前耗用的硫代硫酸钠标准溶液的量,mL
V2——加酸后耗用的硫代硫酸钠标准溶液的量,mL
c——硫代硫酸钠标准溶液的浓度,mol/L
0.0169——与1mmol的硫代硫酸钠相当的二氧化氯的量,g/mmol
0.0355——与1mmol的硫代硫酸钠相当的有效氯量,g/mmol
5——漂液体积,mL
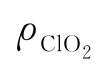 ——ClO2含量,g/L
——ClO2含量,g/L
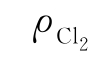 ——Cl2含量,g/L
——Cl2含量,g/L
3.过氧化氢漂液的测定
(1)测定原理
过氧化氢在酸性条件下与碘化钾发生氧化作用,析出碘,然后用Na2S2O3滴定。其反应式如下:
H2O2+2KI+H2SO4→I2+K2SO4+2H2O
I2+2Na2S2O3→Na2S4O6+2NaI
(2)仪器与试剂
a.250mL容量瓶;b.1mL、10mL移液管;c.250mL锥形瓶;d.0.1mol/L硫代硫酸钠标准溶液;e.100g/L碘化钾溶液;f.20%硫酸溶液;g.5g/L淀粉指示剂;h.钼酸铵饱和溶液。
(3)测定步骤
用移液管吸取过氧化氢溶液5mL,于250mL的容量瓶中,加蒸馏水稀释至刻度,摇匀。从容量瓶中吸5mL稀释后的H2O2,于盛有30mL蒸馏水的250mL锥形瓶中,加入20%硫酸溶液10mL,100g/L碘化钾溶液10mL和3滴新配制的钼酸铵饱和溶液,用0.1mol/L硫代硫酸钠标准溶液滴定至浅黄色时,加入淀粉指示剂3mL,继续用0.1mol/L硫代硫酸钠标准溶液滴定至蓝色刚好消失。
(4)结果计算
式中  ——H2O2含量,g/L
——H2O2含量,g/L
V——滴定时耗用的硫代硫酸钠标准溶液的量,mL
c——硫代硫酸钠标准溶液的浓度,mol/L
0.017——与1mmol的硫代硫酸钠相当的过氧化氢的量,g/mmol
5——漂液体积,mL
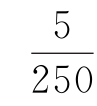 ——稀释体积比
——稀释体积比
4.臭氧产量和消耗量的测定
(1)测定原理
常见臭氧的测定方法有碘量法和紫外吸收法两种,以碘量法较为简单,下面以碘量法为例具体说明。臭氧与中性碘化钾的反应如下:
O3+2KI+H2O →I2+2KOH+O2↑
I2+2Na2S2O3→Na2S4O6+2NaI
(2)仪器与试剂
a.臭氧发生器;b.500mL气体吸收瓶;c.碘化钾溶液(200g/L);d.硫酸溶液(3mol/L);e.0.1mol/L Na2S2O3标准溶液;f.淀粉指示剂。
(3)测定步骤
在500mL气体吸收瓶中,加入200g/L中性碘化钾溶液25mL,用蒸馏水稀释至250mL。通入2L臭氧化气后,在溶液中加入5mL 3mol/L硫酸溶液进行酸化。用0.1mol/L硫代硫酸钠标准溶液滴定至浅黄色时,加入淀粉指示剂3mL,继续用0.1mol/L硫代硫酸钠标准溶液滴定至蓝色刚好消失。
(4)结果计算
式中 ρO3——O3浓度,mg/L
V——滴定时耗用的硫代硫酸钠标准溶液的量,mL
c——硫代硫酸钠标准溶液的浓度,mol/L
2——臭氧气体体积,L(分母)
0.048——与1mmol的硫代硫酸钠相当的臭氧的量,g/mmol
式中 ρ——臭氧浓度,g/m3
qV——每小时进入臭氧发生器的空气流量,m3/h
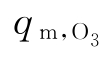 ——臭氧产率,g/h
——臭氧产率,g/h
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




