蒸煮是将植物纤维原料用水和化学试剂经高温处理解离成纸浆的一种方法。蒸煮采用的方法很多,有酸法和碱法,而不同的制浆方法所采用的蒸煮液的化学组成也各不相同。本章我们将基于我国造纸的实际情况,重点介绍烧碱法、硫酸盐法和亚硫酸盐法蒸煮液的配制及目前广泛采用的测定其浓度的化学分析法。如中和法、氧化还原法、容量沉淀法等。
(一)碱法蒸煮液的配制
碱法蒸煮液主要包括烧碱法蒸煮液和硫酸盐法蒸煮液。烧碱法蒸煮液的主要化学成分是NaOH;在NaOH的生产过程或贮存过程中,往往会吸收空气中的二氧化碳,使部分NaOH转化为Na2CO3。因此,烧碱法蒸煮液的成分中,除含有NaOH以外,还常含有一定量的Na2CO3。蒸煮时无论使用固体烧碱或液体烧碱,一般在蒸煮前要先将烧碱溶解和稀释,配制成一定的浓度。
硫酸盐法蒸煮液由氢氧化钠溶液和硫化钠溶液按蒸煮用碱量与硫化度的计算配制而成。因此其主要化学成分为NaOH和Na2S,除此之外,蒸煮液中还含有Na2CO3、Na2SO3、Na2S2O3和Na2SO4等成分。在配碱之前,要按照蒸煮工艺条件中的用碱量、液比、碱液浓度和装锅量进行计算,配碱后还要测定活性碱浓度。
(二)烧碱法和硫酸盐法蒸煮液总碱量的测定
烧碱法蒸煮液总碱量指:NaOH+Na2CO3
硫酸盐法蒸煮液总碱量指:NaOH+Na2S+Na2CO3+Na2SO3
1.测定原理
基于盐酸标准溶液与蒸煮液作用发生中和反应,在烧碱法蒸煮液中发生如下反应:
NaOH+HCl═══NaCl+H2O
Na2CO3+2HCl →2NaCl+H2O+CO2↑
在硫酸盐法蒸煮液中,除发生上述反应外,还发生如下反应:
Na2S+2HCl →2NaCl+H2S↑
Na2SO3+HCl →NaHSO3+NaCl
NaHSO3+HCl →NaCl+H2O+SO2↑
2.仪器与试剂
a.25mL、50mL移液管各一支;b.500mL容量瓶一个;c.300mL锥形瓶两个;d.50mL白色滴定管一支;e.500mL量筒一个;f.1g/L甲基橙指示剂;g.0.5mol/L盐酸标准溶液等。
3.测定步骤
取一500mL容量瓶,预先注入新煮沸而已冷却的蒸馏水至半满。再用移液管吸取25mL蒸煮液于容量瓶中,然后加蒸馏水稀释至刻度,摇匀。
用移液管吸取50mL上述制备好的稀释液于300mL锥形瓶中,加入1~2滴甲基橙指示剂,用0.5mol/L盐酸标准溶液滴定至恰好显橙红色。
4.计算结果
烧碱法蒸煮液的总碱量按式(3-2)计算:
硫酸盐法蒸煮液的总碱量按式(3-3)计算:
式中 V——滴定时消耗HCl标准溶液量,mL
c——HCl标准溶液的浓度,mol/L
0.04和0.031——与1mmol的盐酸相当NaOH和Na2O质量,g/mmol
25——蒸煮液体积,mL
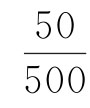 ——稀释体积比
——稀释体积比
两份平行试验的误差不应超过0.15g/L。
(三)烧碱法和硫酸盐法蒸煮液活性碱的测定
烧碱法蒸煮液的活性碱指:NaOH含量
硫酸盐法蒸煮液的活性碱指:NaOH+Na2S含量
1.测定原理
在蒸煮液中先加氯化钡,使氯化钡与碳酸盐、硫酸盐和亚硫酸盐反应,生成相应的碳酸钡,硫酸钡和亚硫酸钡沉淀,然后再用HCl标准溶液滴定蒸煮液中的活性碱,其反应式如下:
Na2CO3+BaCl2→2NaCl+BaCO3↓
Na2SO4+BaCl2→2NaCl+BaSO4↓
Na2SO3+BaCl2→2NaCl+BaSO3↓
NaOH+HCl →NaCl+H2O
Na2S+2HCl →2NaCl+H2S↑
2.仪器与试剂
a.500mL容量瓶一个;b.300mL锥形瓶两个;c.25mL、50mL移液管各一支;d.容量50mL白色滴定管一支;e.500mL、100mL量筒各一支;f.1000mL烧杯一支;g.调温电炉一个;h.0.5mol/L盐酸标准溶液;i.1g/L甲基橙指示剂;j.100g/L氯化钡溶液等。
3.测定步骤
取一500mL容量瓶,预先注入新煮沸且已冷却的蒸馏水至半满,再用移液管吸取25mL蒸煮液于容量瓶中,再加入100g/L氯化钡溶液至沉淀完全(沉淀下沉后,用清洁玻璃棒蘸此溶液,滴于盛有稀硫酸的试管中试之,如无白色沉淀,则应再加氯化钡,直至出现白色沉淀为止),并有微过量氯化钡存在为止。最后加水稀释至刻度,摇匀。静置,以使生成的碳酸钡、硫酸钡和亚硫酸钡沉淀下降。
用移液管从容量瓶中吸取50mL上层清液于300mL锥形瓶中,加入1~2滴甲基橙指示剂,用0.5mol/L盐酸标准溶液滴定至恰好显橙红色为止。
4.计算结果
烧碱法蒸煮液中的活性碱含量ρ活碱量(g/L)按式(3-4)计算:
硫酸盐法蒸煮液中的活性碱含量ρ总碱量(g/L)按式(3-5)计算:
式中 V——滴定时消耗HCl标准溶液量,mL
c——HCl标准溶液的浓度,mol/L
0.04和0.031——与1mmol的盐酸相当NaOH和Na2O质量,g/mmol
25——蒸煮液体积,mL
 ——稀释体积比
——稀释体积比
两份平行试验的误差不应超过0.4g/L。
(四)烧碱法蒸煮液的双指示剂法分析
除了上述方法测定烧碱法蒸煮液的总碱量和活性碱外,还可采用双指示剂法在一次分析中同时测定出蒸煮液中氢氧化钠和碳酸钠的含量,具体方法如下。
1.测定原理
在混合碱的试液中加入酚酞指示剂,用HCl标准溶液滴定至溶液呈微红色。此时试液中所含NaOH完全被中和,Na2CO3也被滴定成NaHCO3,反应如下:
NaOH+HCl═══NaCl+H2O
Na2CO3+HCl═══NaCl+NaHCO3
再加入甲基橙指示剂,继续用HCl标准溶液滴定至溶液由黄色变为橙色即为终点。此时NaHCO3被中和成H2CO3,反应为:
NaHCO3+HCl═══NaCl+H2O+CO2↑
设第一次滴定时所消耗的盐酸标准液的体积为V1,第一次滴定终点至第二次滴定终点耗用的盐酸标准溶液为V2。则V1-V2为氢氧化钠耗用的盐酸标准溶液量;2V2为碳酸钠所耗用的盐酸标准溶液。因而可分别依据上述消耗的盐酸标准溶液的量计算出氢氧化钠和碳酸钠的含量。
2.仪器与试剂
a.25mL及10mL移液管各一根;b.250mL容量瓶;c.250mL锥形瓶;d.50mL滴定管;e.0.5mol/L盐酸标准溶液。
3.测定步骤
用移液管吸取25mL烧碱蒸煮液于250mL容量瓶中,加蒸馏水稀释后摇匀。另取一移液管,吸取上述稀释液10mL于250mL锥形瓶中,加入酚酞指示剂1~2滴,用盐酸标准溶液滴定至酚酞退为无色,记下盐酸标准溶液的消耗量为V1;然后往锥形瓶中加入1~2滴甲基橙指示剂,继续用盐酸标准溶液滴定至橙红色,记下第一次滴定终点至第二次滴定终点所消耗的盐酸标准溶液量,记为V2。
4.结果计算
NaOH含量ρNaOH(g/L)和Na2CO3含量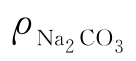 (g/L)计算见式(3-6)和式(3-7):
(g/L)计算见式(3-6)和式(3-7):
式中 V1——第一次滴定时消耗的HCl标准溶液量,mL
V2——第一次滴定终点至第二次滴定终点所消耗的盐酸标准溶液的量,mL
c——HCl标准溶液的浓度,mol/L
25——烧碱蒸煮液体积,mL
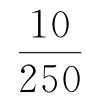 ——稀释体积比
——稀释体积比
0.04和0.053——与1mmol的盐酸相当NaOH和Na2CO3的质量,g/mmol
(五)硫酸盐法蒸煮液硫化钠的测定
硫酸盐法蒸煮液的主要成分是NaOH和Na2S,此外,常含有其他含硫的还原物,如Na2SO3和Na2S2O3等。测定Na2S的方法有三种:硝酸银铵法、还原物法和双指示剂法。三种方法中,硝酸银铵法,操作简便,且准确度较高,得到广泛采用。还原物法又称碘量法,此法测得的Na2S含量实际上为总还原物的量,而总还原物除Na2S外,还包括Na2SO3和Na2S2O3,因此结果会偏高,而且操作较繁。双指示剂法一般测定结果偏高,且具有不稳定性,因为Na2S是强碱弱酸盐,会发生部分水解反应,同时容易受空气氧化。
1.硝酸银铵法
(1)测定原理
基于硫化钠能与硝酸银铵溶液作用,生成黑色硫化银沉淀,最后根据硝酸银铵标准溶液的消耗量,测得硫化钠的含量。化学反应为:
2AgNO3+Na2S →2NaNO3+Ag2S↓(黑色)
硝酸银铵溶液中必须加入氢氧化铵的原因是使其形成离解度非常低的银铵络离子,一般制造硫化钠的原料(芒硝)中都有一定量的氯化钠带入到硫化钠中,而银铵络离子只能使溶解度极低的硫化银沉淀出来,从而防止氯化银沉淀。
(2)试剂
硝酸银铵标准溶液——称取87.07g硝酸银溶解于少量蒸馏水中,加250mL氢氧化铵(相对密度为0.9),然后移入1000mL容量瓶中,加蒸馏水至刻度,摇匀后装入棕色试剂瓶中备用。此硝酸银铵标准溶液,1mL相当于0.02g硫化钠。
(3)测定步骤
用移液管吸取25mL蒸煮液于500mL的锥形瓶中,由滴定管滴入硝酸银铵标准溶液。滴定时慢慢旋动锥形瓶,使生成的硫化银沉淀凝聚,接近终点时剧烈地旋动锥形瓶,使沉淀聚集于透明的浅褐色溶液中,继续滴定。每滴加一滴硝酸银铵溶液,就剧烈地旋动锥形瓶,直至不再有黑色沉淀形成即为终点,记录硝酸银铵标准溶液耗用量。
(4)计算结果(https://www.xing528.com)
硫化钠含量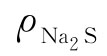 (g/L)按式(3-8)计算:
(g/L)按式(3-8)计算:
式中 V——滴定时消耗的硝酸银铵标准溶液量,mL
0.02——1mL相当0.02g Na2S质量,g/mL
25——蒸煮液体积,mL
(5)注意事项
开始滴定时,滴定速度可以快一些,而锥形瓶的旋动应慢一点,这样有利于形成大颗粒的沉淀。接近滴定终点时,滴定速度要慢,逐滴加入,并伴随剧烈旋动,使新生成的沉淀被大颗粒沉淀吸附,有利于终点的观察。
2.还原物法(又称碘量法)
(1)测定原理
在硫酸盐法蒸煮液中加入过量的碘溶液。使各还原物与碘反应,然后再用硫代硫酸钠标准溶液滴定过量的碘,即可计算出硫化钠含量。有关的反应如下:
Na2S+I2→2NaI+S
Na2SO3+I2+H2O →Na2SO4+2HI
2Na2S2O3+I2→Na2S4O6+2NaI
(2)仪器与试剂
a.10mL,25mL移液管各一支;b.100mL容量瓶一个;c.50mL滴定管两支;d.250mL锥形瓶两个;e.5mL、10mL、25mL量筒;f.0.05mol/L碘标准溶液;g.0.1mol/L硫代硫酸钠标准溶液;h.20%醋酸溶液;i.0.5%淀粉指示剂。
(3)测定步骤
用移液管吸取25mL蒸煮液于100mL的容量瓶中,加水稀释至刻度,摇匀备用。从滴定管中放出0.05mol/L碘标准溶液25~30mL于250mL锥形瓶中,加5mL 20%醋酸,并用约30mL水冲洗锥形瓶之内壁,摇匀,然后注入10mL以上稀释的蒸煮液于酸化的碘液中,摇匀。用0.1mol/L硫代硫酸钠标准溶液滴定过量的碘至淡黄色,加入2~3mL新配置的淀粉指示剂,继续滴定至蓝色消失为止。
(4)计算结果
总还原物(以Na2S计)含量ρ总还原物(g/L)按式(3-9)计算:
式中 V1——加入碘溶液的体积,mL
c1——碘溶液的浓度,mol/L
V2——消耗硫代硫酸钠标准溶液的体积,mL
c2——硫代硫酸钠溶液的浓度,mol/L
25——蒸煮液体积,mL
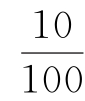 ——稀释体积比
——稀释体积比
0.078——与1mmol碘溶液相当的硫化钠的量,g/mmol
测两份平行试验,误差不超过0.20g/L。
(5)注意事项
还原物法测得的硫化钠含量,实际上为总还原物的含量,因蒸煮液中除有硫化钠外,尚有亚硫酸钠和硫代硫酸钠等还原物,它们也能与碘发生反应。还原物法测得的硫化钠含量,结果比硝酸银铵法偏高,但由于亚硫酸钠和硫代硫酸钠含量很少,可以忽略不计,故本方法使用仍比较普遍。
3.双指示剂法
(1)测定原理
与碳酸钠相同,硫化钠也是二元弱酸盐,在不同的pH可以中和到不同程度。先后以酚酞和甲基橙为指示剂,用盐酸标准溶液滴定,从而经过计算可求出不同组分的含量。
(2)测定步骤
吸取25mL蒸煮液于预先盛有不含二氧化碳的蒸馏水的500mL容量瓶中,加入100g/L的氯化钡,使蒸煮液中的碳酸钠和亚硫酸钠完全被沉淀,吸取澄清液50mL于300mL锥形瓶中,先以酚酞为指示剂,用0.5mol/L的盐酸标准溶液滴定至终点,设盐酸标准溶液的用量为V1mL。再于滴定后的溶液中添加甲基橙指示剂1~2滴,继续用盐酸标准溶液滴定至橙红色,设此时的盐酸标准溶液总用量为V2mL。
(3)计算结果
以酚酞为指示剂滴定至终点时,所测组分为:NaOH+1/2Na2S
以甲基橙为指示剂滴定至终点时,所测组分为:NaOH+Na2S
氢氧化钠含量ρNaOH(g/L)和硫化钠含量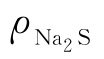 (g/L)按式(3-10)和式(3-11)计算:
(g/L)按式(3-10)和式(3-11)计算:
式中 c——盐酸标准溶液的浓度,mol/L
25——蒸煮液体积,mL
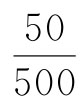 ——稀释体积比
——稀释体积比
0.04及0.039——分别与1mmol的盐酸相当的氢氧化钠及硫化钠的量,g/mmol
(六)亚硫酸盐蒸煮液的配制
现代亚硫酸盐法制浆,已由过去的酸性亚硫酸钙法向可溶性盐基(例如:Mg2+、NH4+、Na+)发展,因此蒸煮液的pH范围很广(pH为1~13)。不同pH的亚硫酸盐法制浆,可以适应不同原料。
不同pH的亚硫酸盐蒸煮,其蒸煮液中的主要化学成分随pH的不同而不同。如表3-1所示,配制不同pH的亚硫酸盐蒸煮液,可以在制酸时吸收不同量的二氧化硫来调制。
表3-1 亚硫酸盐蒸煮液的组成
蒸煮液的pH要求不同,所采用的盐基亦应不同。一般pH小于2时多采用钙盐基,即酸性亚硫酸钙;pH3~6时多采用镁盐基,即亚硫酸氢镁;pH8~9时常采用铵盐基或钠盐基;pH大于10时,则采用钠盐基。
(七)酸性亚硫酸盐蒸煮液的测定
酸性亚硫酸盐蒸煮液的主要成分有亚硫酸氢盐、亚硫酸和溶解二氧化硫。所以在测定其蒸煮液时分为总二氧化硫、游离二氧化硫和化合二氧化硫。所谓总二氧化硫是指游离二氧化硫与化合二氧化硫之和。游离二氧化硫则指蒸煮液中以游离状态存在的二氧化硫及亚硫酸氢盐中所含二氧化硫总量的一半。
1.测定原理(以镁盐蒸煮液为例)
与碘的氧化还原反应用以测定总SO2含量
与氢氧化钠中和反应用于测定游离SO2的含量
Mg(HSO3)2+2NaOH →MgSO3+Na2SO3+2H2O
2.仪器与试剂
a.100mL容量瓶;b.250mL锥形瓶;c.50mL白色滴定管;d.0.05mol/L碘标准溶液;e.0.1mol/L NaOH标准溶液;f.5g/L淀粉指示剂。
3.测定步骤
(1)试样制备
用移液管吸取蒸煮液10mL于已盛有一部分蒸馏水的100mL容量瓶中,然后用蒸馏水稀释至刻度,摇匀,备用。
(2)总二氧化硫的测定
取容量为250mL的锥形瓶,预先注入50~100mL蒸馏水及1~2mL新配制的浓度为5g/L淀粉指示剂。用移液管吸取10mL上述稀释好的蒸煮液于锥形瓶中,以0.05mol/L碘标准溶液滴定至恰好显蓝色。
总SO2含量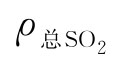 (g/L)按式(3-12)计算:
(g/L)按式(3-12)计算:
式中 V——滴定时所耗用I2标准溶液量,mL
c——I2标准溶液的浓度,mol/L
0.064——与1mmol的碘相当的二氧化硫的量,g/mmol
10——蒸煮液体积,mL
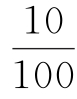 ——稀释体积比
——稀释体积比
(3)游离二氧化硫的测定
取容量250mL锥形瓶,预先注入50~100mL蒸馏水及数滴酚酞指示剂,用移液管吸取10mL上述稀释蒸煮液注入锥形瓶,以0.1mol/L NaOH标准溶液滴定至恰好显粉红色并能稳定60s为止。
式中 V——滴定时所耗用NaOH标准溶液量,mL
c——NaOH标准溶液的浓度,mol/L
0.032——与1mmol的NaOH相当的二氧化硫的量,g/mmol
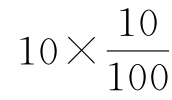 ——含义同式(3-12)
——含义同式(3-12)
(4)化合SO2计算
(八)无水亚硫酸钠含量的测定
中性或碱性亚硫酸盐法蒸煮液常用固体亚硫酸钠加碱(NaCO3或NaOH)配制而成。由于亚硫酸钠不稳定,极易氧化,在蒸煮试验时一般多采用即时称取固体亚硫酸钠溶解后送入蒸煮器,也可以配成溶液测定浓度后使用。但亚硫酸钠溶液不宜久存。使用前必须再标定。
1.测定原理
利用过量的碘在酸性条件下与亚硫酸钠反应,然后用硫代硫酸钠标准溶液滴定剩余的碘。通过消耗硫代硫酸钠的量计算亚硫酸钠含量。
2.测定步骤
用减量法快速准确称取试样0.25g(精确至0.0001g),置于250mL锥形瓶中,事先在瓶中加入0.1mol/L I2标准溶液50mL及蒸馏水30~50mL,混合后静置5min,加入浓盐酸1mL,混均。以0.1mol/L的Na2S2O3标准溶液滴定至淡黄色时,加入5mL淀粉指示剂,继续滴定至蓝色刚好消失。
3.结果计算
式中 V——加入的I2标准溶液的量,mL
c——I2标准溶液的浓度,mol/L
V1——滴定时消耗的Na2S2O3的量,mL
c1——Na2S2O3标准溶液的浓度,mol/L
0.126——与1mmol的I2相当的Na2SO3的量,g/mmol
m——试样质量,g
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




