金属与氧的亲和力大小通常可由它们氧化物的生成热和分解压来判断,氧化物的生成热越大、分解压越小,则与氧的亲和力就越强。镁与1g氧气化合时放出598J的热量,而铝放出531J的热量。氧化物的生成热和分解压数值表明,镁与氧的化学亲和力要比铝与氧的大。镁与铝的另一区别是,镁被氧化后表面形成疏松的氧化膜,其致密度系数α=0.79(Al2O3的α=1.28),这种不致密的表面膜会在金属液面上产生张应力,使其下部进一步氧化燃烧。镁的氧化动力学曲线呈直线形式,可见氧化速率与时间无关,氧化过程完全由反应界面控制。镁的氧化与温度关系密切,温度较低时镁的氧化速率不大;温度高于773K时,氧化速率加快;当温度超过熔点923K时,其氧化速率急剧增加,遇见氧即发生激烈的氧化而燃烧,放出大量的热。反应生成的氧化镁导热性极差,使反应界面所产生的热不能迅速向外散发,进而提高了界面上的温度,这样恶性循环势必加速镁的氧化,燃烧反应更加激烈。反应界面的温度也越来越高,甚至可达3123K,远高于镁的沸点(1380K),引起镁熔体大量汽化,最终发生爆炸。
金属的抗氧化能力取决于表面膜阻碍反应物通过的能力,也就是说取决于表面膜的致密度系数。致密度系数α是金属氧化物和生成该氧化物所消耗金属体积的比值。如果氧化物的体积小于生成这些氧化物所消耗金属的体积,则氧化速度将与时剧增;如果氧化物的体积超出生成它的金属体积,则氧化速度将随时间的增长而减小。各种金属元素的α值见表3-1。
表3-1 各种金属元素的α值

由上述α值可知,Al、Be、Si等元素的α值大于1,即氧化膜中产生压应力。由于氧化膜的抗压强度比抗拉强度大,在较高的压力下氧化膜也不破裂,因此氧化膜是致密且连续的,使氧与金属的接触受到氧化膜的限制。随着氧化膜的增厚,氧化速率迅速降低,这对金属液的继续氧化有很好的抑制作用。而另外一些元素,如Mg、Ca、Na、K等α值小于1,生成的金属氧化物的体积小于氧化反应所消耗掉的金属的体积,这说明氧化膜是疏松的。氧可以通过氧化膜的缝隙直接到达金属液,这样氧化膜对金属液就没有保护作用,因此金属的氧化速度不变。
由此可见,铝在熔化过程中,一般无须特殊保护,而镁及其合金在全过程中都需要进行保护。(https://www.xing528.com)
在镁合金中现在已知的只有Mg-Be和Mg-Ce-La两个合金系的氧化速度比纯镁小。
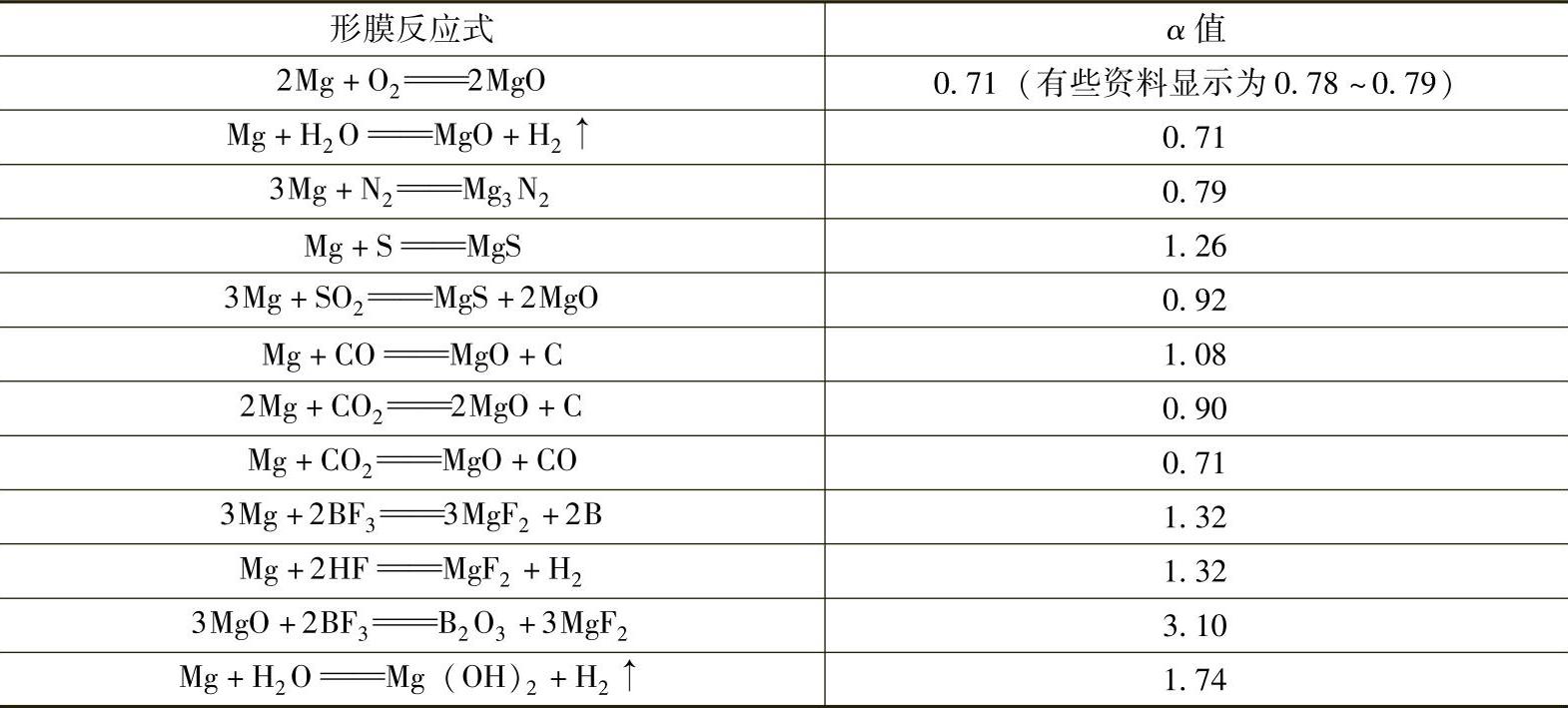
镁和其他元素形成的各种化合物,其α值大小是鉴别它对熔体镁合金保护作用的标志。值得注意的是,即使生成物是同样的,但由于伴生产物不同,其保护作用并不一样。镁合金和组元形膜反应式及α值见表3-2。从表3-2可以看出,熔体镁合金的保护措施还大有选择余地。
表3-2 镁合金和组元形膜反应式及α值
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




