1.杂质作用
(1)n型半导体。在硅中加入元素周期表中的Ⅴ族元素磷(P)、砷(As)、锑(Sb)后,就能得到n型半导体,常用的是磷(P)、锑(Sb)。硅外层有4个价电子,磷(P)、锑(Sb)外层有5个价电子,掺杂后,磷(P)、锑(Sb)代替硅原子,并贡献出4个价电子,与周围的硅原子形成共价键结合,剩余的1个价电子(带负电)成为自由电子,参加导电。磷(P)、锑(Sb)贡献出1个价电子参加导电,称为“施主杂质”。
(2)p型半导体。在硅中加入元素周期表中的Ⅲ族元素硼(B)、铝(Al)、镓(Ga)、铟(In),就能得到p型半导体,常用的是硼(B)。硼(B)原子外层有3个价电子,掺杂后,硼(B)代替硅原子,并贡献出3个价电子与周围的硅原子形成共价键结合。因为少了1个价电子,产生了1个硅的悬挂键,形成一个空穴(带正电),邻近的电子过来填补,又在邻近处形成一个新的空穴,相当于空穴在运动,参与导电,称为空穴导电。硼(B)元素要接受1个电子才能参与导电,称为“受主杂质”
2.杂质效应 杂质进入硅熔液之后,会扩散到整个熔液中,这是杂质的扩散效应;有一些杂质会蒸发,这是杂质的蒸发效应;在结晶过程中,进入固态的杂质和留在熔液中的杂质,浓度是不一样的,这是杂质的分凝效应。
(1)扩散效应。扩散就是杂质原子、分子在气体、液体或固体中进行迁移的过程。在气体中迁移快,液体中次之,固体中最慢,而且总是从杂质浓度高的地方向浓度低的地方迁移。为了说明扩散效应,引入杂质浓度梯度的概念。设在x方向上,单位长度Δx内的杂质浓度变化为Δs,当Δx→0时,则浓度梯度可以用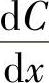 来表示,在单位时间内,在垂直于x方向上的单位面积中,扩散杂质的原子数J可以表示为
来表示,在单位时间内,在垂直于x方向上的单位面积中,扩散杂质的原子数J可以表示为

式中 D———扩散系数(cm2/s);负号表示扩散的方向与杂质浓度增加的方向相反。
扩散系数是温度的函数,随着温度上升呈指数增加。实验测得在1200℃各种杂质在固体硅中的扩散系数D,列于表6-4。
表6-4杂质在硅中的扩散系数D
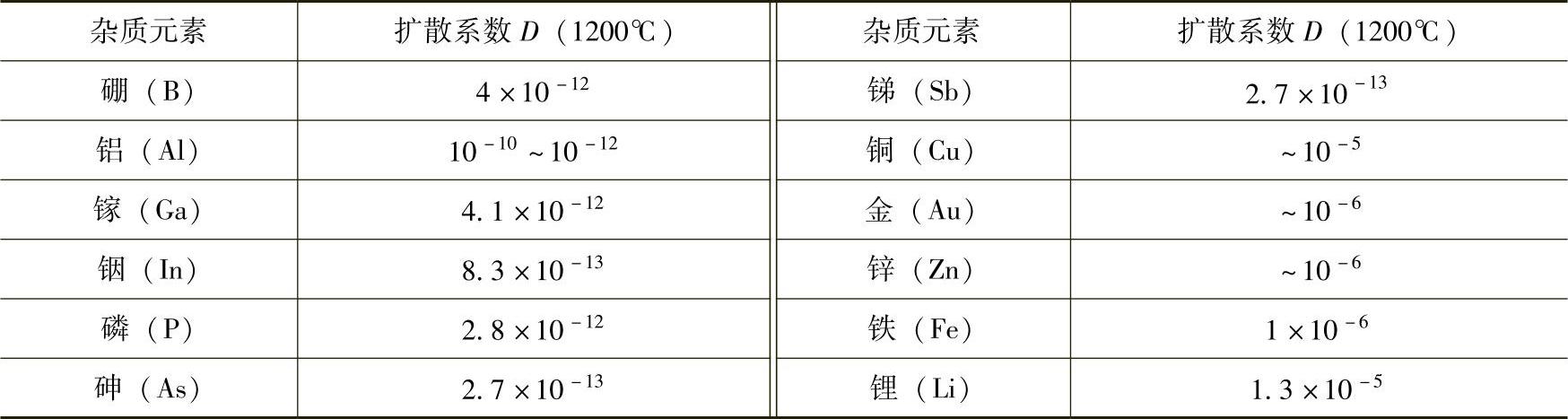
从表中可以看出,硼、磷、砷、锑等杂质扩散系数比较小,在硅中扩散比较慢,而铜、铁、金、锂等杂质扩散较快。
(2)蒸发效应。掺入硅熔液中的杂质在高温下会不断蒸发,特别是在真空状态下会更显著,常以杂质蒸发的速度常数和时间常数来描述蒸发效应。
1)杂质蒸发速度常数。由于掺入的杂质量往往很少,于是可以认为杂质蒸发符合理想气体规律。在一定温度下,在杂质的平衡蒸发条件下,根据气体分子运动论,可以推算出单位时间内,某杂质从熔体单位面积上蒸发出来的原子数,与熔体中杂质浓度之比,称为杂质蒸发速度常数,用EV表示,在单位时间内,从硅熔体中蒸发出来的杂质总量N可表示为
N=EVAcI (6-10)
式中 N———杂质总量(g);
EV———杂质蒸发速度常数(cm/s);
A———熔体蒸发表面积(cm2);
cI———熔体中杂质浓度(at/cm3)。
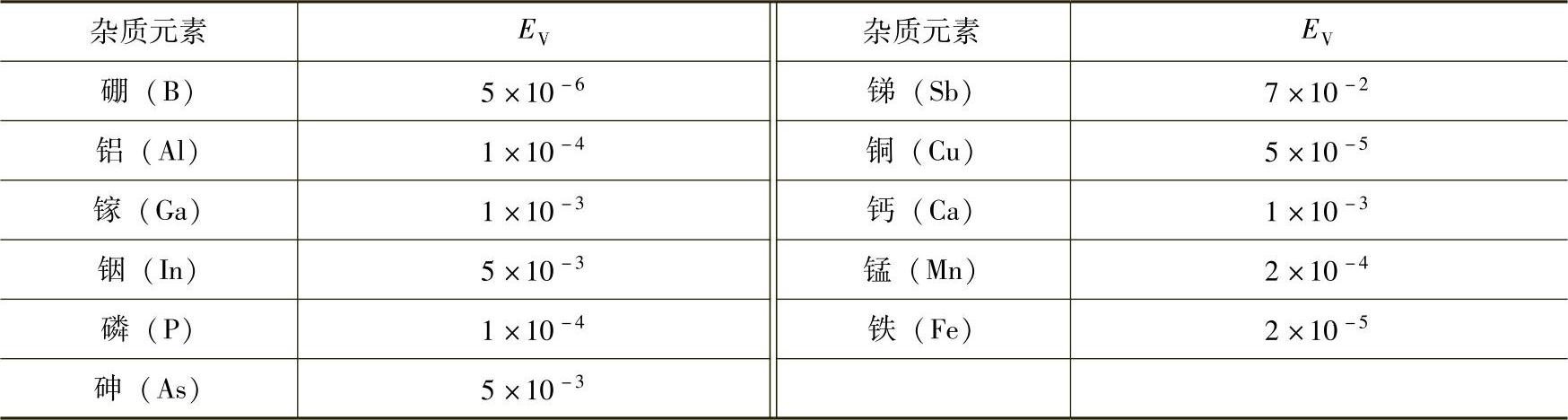
EV的数值越大,越容易蒸发。表6-5列出杂质蒸发速度常数EV。从表中可以看出,熔体中的杂质锑、砷、铟、镓最容易蒸发,而硼、铜、铁则最难以蒸发。
表6-5杂质蒸发速度常数EV
2)杂质蒸发时间常数。熔体中的杂质浓度c会由于不断蒸发而随着时间t的加长而逐渐下降;另外,如果单位重量熔体所铺开的表面积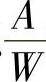 越大,蒸发越快,浓度下降就快些,所以,杂质浓度随着时间的变化率
越大,蒸发越快,浓度下降就快些,所以,杂质浓度随着时间的变化率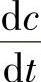 正比于
正比于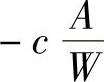 (负号表示浓度随时间而降低),同时,它应该和杂质蒸发速度常数成正比,即
(负号表示浓度随时间而降低),同时,它应该和杂质蒸发速度常数成正比,即
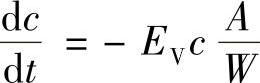
求得
式中 c0———某种杂质的初始浓度(at/cm3);
c———某种杂质在经过时刻t后的浓度(at/cm3);
A———熔体蒸发表面积(cm2);
W———熔体质量(g);
t———时间(s)。
当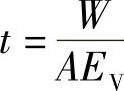 时,则有
时,则有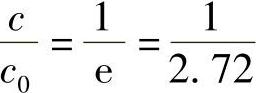 ,将这个时间称为杂质蒸发时间常数Et,即
,将这个时间称为杂质蒸发时间常数Et,即

显然,蒸发时间与杂质种类、熔体质量、蒸发面积的不同而有所不同。实验得出的数据列于表6-6。(https://www.xing528.com)
表6-6杂质蒸发时间常数Et

从表6-7可以看出:锑蒸发时间最快,降到初始浓度的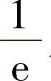 只要0.2min;砷和铟需要3min;镓需要12min,利用蒸发去除这些杂质比较容易。但是,铁需要10h,硼需要50h,难以用蒸发效应去除。这些杂质掺入硅熔体中,要采取一些特殊措施来保证合格的电阻率。
只要0.2min;砷和铟需要3min;镓需要12min,利用蒸发去除这些杂质比较容易。但是,铁需要10h,硼需要50h,难以用蒸发效应去除。这些杂质掺入硅熔体中,要采取一些特殊措施来保证合格的电阻率。
(3)分凝效应。在硅单晶生长过程中,熔体结晶为固体的物态转变,在关键部位———固液交界面上,会发生杂质的分凝效应,即杂质并不按照在熔体中的浓度进入固体,或许浓度低,或许浓度高,这种现象就是杂质的分凝效应。在不同情况下,又分为平衡分凝系数和有效分凝系数。
1)平衡分凝系数K0。设想一种理想的结晶状态,液相中的杂质很稀少,它的结晶速度非常缓慢。在结晶时,交界面附近由于分凝产生的浓度变化,有充分的时间进行调整,随时达到新的平衡,杂质浓度随时都是均匀的。在固相平衡时,有两种情况,一种情况是固相中的杂质浓度要比液相中的杂质浓度低很多,也就是说在结晶时,固相有意排斥一些杂质,不让其进入固相,因而杂质浓度就低很多;另一种情况正好相反,固相有意吸收一些杂质进来,从而提高了固相的杂质浓度。设K0为平衡分凝系数,它表示在固液平衡时,固相中的杂质浓度和液相中的杂质浓度的比值,即

式中 K0———平衡分凝系数;
cs———固相中的杂质浓度(at/cm3);
cL———液相中的杂质浓度(at/cm3)。
若K0=1,表示在凝固时,固相、液相中的杂质浓度是一样的;若K0<1,表示在凝固时,固相杂质浓度低于液相中的杂质浓度;若K0﹥1,表示在凝固时,固相杂质浓度高于液相中的杂质浓度。
在同一种物质熔体中,分别掺入各种不同杂质,在结晶时,各自的平衡分凝系数K0是不一样的,大约在10-7~20之间;同一种杂质分别掺入不同的熔体中,在结晶时,各自的平衡分凝系数K0也是不一样的。例如:硼(B)在硅中的平衡分凝系数K0为0.9,而在锗中的平衡分凝系数K0为20。一般来说,若杂质是降低结晶物质的熔点,则K0<1;反之,若杂质是提高结晶物质的熔点,则K0﹥1。所以在定向凝固过程中,由于杂质分凝效应,结晶界面可能会排斥某些杂质(对于K0<1的杂质),又可能吸收某些杂质(对于K0﹥1的杂质)。表6-7列出杂质在硅中的K0值。
硼(B)在硅中的平衡分凝系数K0为0.9,用分凝效应提纯不易除去硅中的硼。生产区熔高阻硅单晶时,多次反复地将熔区从籽晶端移向尾部,也就多次反复地将绝大多数杂质集中到了尾部,然后切去尾部,就得到了更为纯净的硅材料。图6-18示出区熔提纯。
表6-7杂质在硅中的K0值
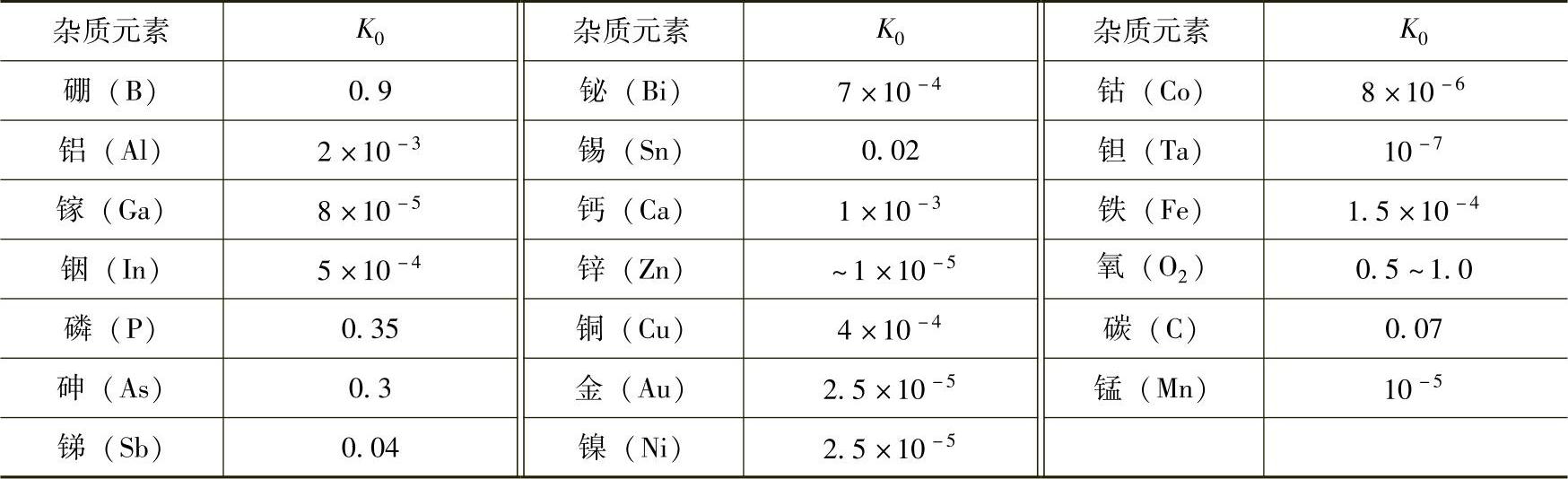
由于硼难以除去,就留在硅材料中,制成p型单晶硅。知道了不同杂质的分凝系数,就为计算掺杂量时提供了依据,也为选择何种掺杂剂提供了参考。例如在硅中,硼的分凝系数K0为0.9,铝的分凝系数K0=2×10-3。为了得到同样的电阻率,掺硼所需要的杂质量要少得多,这样还可以减少由于掺杂剂带入超纯硅中的有害杂质量。
2)有效分凝系数Keff。上面介绍的平衡分凝系数是理想状态下的分凝系数。实际生产中,晶体生长速度不可能非常缓慢,界面排斥出来的杂质也不可能及时扩散开去。存在两种情况:
① K0<1的情况。当生长界面以一定的速度向前推进时,生长界面就会排斥这种杂质,杂质就会在液相侧产生聚集。如果排斥这种杂质的速度,大于聚集杂质向外扩散的速度,那么在液相侧的杂质聚集就越来越多,形成一个杂质高浓度富集区,厚度为“δ”。结晶速度越快,杂质排出越快,“δ”值就越大。这种情况下,分凝到固相的杂质浓度cS已和“δ”中的杂质浓度cI有直接关系了,分凝系数是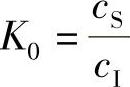 ,不再是原先的
,不再是原先的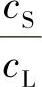 ,而此时的
,而此时的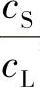 称为有效分凝系数Keff,即
称为有效分凝系数Keff,即
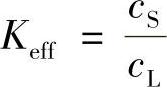
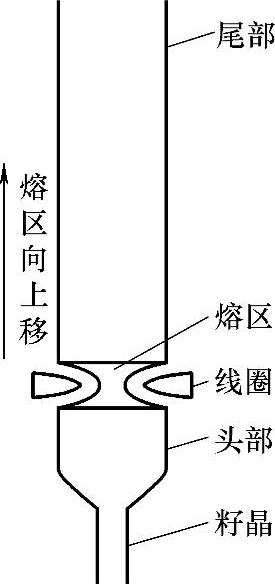
图6-18 区熔提纯
将cS=K0cI代入上式,得

因为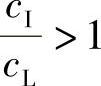 ,所以Keff﹥K0
,所以Keff﹥K0
结晶的速度越快,杂质聚集就越浓厚,cI就越大,Keff就越大,进入固相的杂质就越多。随着结晶时间的加长,熔体中的杂质浓度cL不断增长,cI也在逐渐增加,于是进入固相的杂质浓度cS也是随着时间加长而不断增加的;如果放慢结晶速度,并加强熔体搅拌,迫使“δ”变薄,降低cI值,让它接近cL,这时Keff≈K0。
② K0﹥1的情况。当生长界面以一定的速度向前推进时,生长界面就会吸收这种杂质,导到液相侧杂质浓度降低,如果吸收这种杂质的速度,大于周围杂质向交界面扩散的速度,那么在液相侧的杂质就越来越少,形成一个低浓度的贫乏区,厚度为“δ”,结晶速度越快,杂质吸收就越快,“δ”值就越大。这种情况下,分凝到固相的杂质浓度cS,已和“δ”中的杂质浓度cI有直接关系了,分凝系数是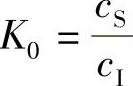 ,不再是原先的
,不再是原先的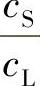 ,而此时的
,而此时的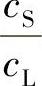 称为有效分凝系数Keff,即
称为有效分凝系数Keff,即
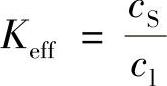
将cS=K0cI代入上式,得

因为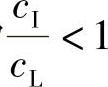 ,所以Keff<K0。
,所以Keff<K0。
结晶的速度越快,杂质贫乏区就越稀薄,cI就越小,Keff就越小,进入固相的杂质就越少。随着结晶时间的加长,熔体中的杂质浓度cL不断减少,cI也在不断减少,于是进入固相的杂质浓度cS也是随着时间加长而不断地减少的;如果放慢结晶速度,并加强熔体搅拌,迫使“δ”变厚,增加cI值,让它接近cL,这时Keff≈K0。
③K0=1时,即cS=cI=cL,就不存在分凝效应了。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




