Maneesh K等人提出了一种3D打印刺激响应型核/壳胶囊的方法,如图10-17所示。这些胶囊以水为核心,乙醇酸(PLGA,FDA批准的聚合物)为外壳,能够以可编程方式在水凝胶基质内释放多重梯度芯材。重要的是,壳体可以加载等离子体金纳米棒(AuNRs)。当用纳米棒的长度对应的激光波长光源照射时,胶囊会发生选择性破裂。此工艺可以实现对空间,时间和选择性的精确控制。这种基于3D打印的方法的优点包括:高度单分散的胶囊,有效包裹生物分子有效载荷,胶囊阵列的精确空间图案,梯度的“实时”可编程重配置,纳入分层体系结构的通用性。
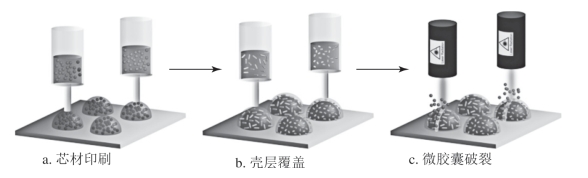
图10-17 3D打印刺激响应型核/壳胶囊的方法
胶囊的可编程印刷和破裂:①将包含生物分子有效载荷的水芯材的多阵列直接印刷在固体基质上;②将含有不同长度AuNRs的PLGA溶液直接分散于水核心中,形成固体刺激响应型外壳;③通过用与纳米棒的吸收峰相对应的激光波长照射选择性地使胶囊破裂。
麻省理工学院的研究人员研制出一种生产纳米纤维网格的新装置。新装置由一组小型喷嘴组成,其中包含泵送的聚合物颗粒的流体。在最初的实验中,Velásquez-García和Olvera-Trejo使用水和芝麻油作为流体,而发射器则由塑料制成,所得微球的直径约为25μm。
为了将发射器阵列封装到最小的体积中,研究人员使用了螺旋形的流体通道,如图10-18所示。该通道围绕发射器的内部呈螺旋形旋转,从而最大限度地减小了其高度。为了控制发射速率,通道也逐渐变细,从底部的0.7 mm到顶部的0.4 mm。Velásquez-García表示,使用标准的微细加工工艺几乎不可能制造出这种小型而复杂的设备。

图10-18 螺旋形流体通道及其横截面
Wang J等提出了一种提高增材制造成品机械性能的方法,如图10-19所示。将热膨胀型微胶囊加入到原材料中,通过熔融沉积成型(Fused Deposition Modeling,FDM)和热处理工艺来降低沉积层之间的空隙,从而提高机械性能。同时,形成了一种基于FDM制备发泡材料的新型工艺,此工艺在制鞋领域中拥有巨大的发挥潜力。目前广泛应用在FDM的原材料主要是丙烯腈-丁二烯-苯乙烯塑料(ABS)和聚乳酸(PLA),它们的熔点接近190℃,可以选用起始膨胀温度高于190℃的超高温热膨胀型微胶囊,产品的机械性能得到提高。

图10-19 热可膨胀微球加工流程
SmartCups公司发布了全世界第一款3D打印聚合物微胶囊能量饮料杯,如图10-20所示。这种杯子选用微胶囊化技术,将活性化学物质和特色美食化学物质包覆在其中,然后运用3D打印技术,将这种微胶囊打印集成化于在可降解的杯底。当有液体引入时,微胶囊的壁材会溶解破损,芯材的活性成分和特色美食化学物质释放出,不用拌和就变成了一杯即饮健康饮品。
 (https://www.xing528.com)
(https://www.xing528.com)
图10-20 3D打印聚合物微胶囊能量饮料杯
多年来,Scott White一直致力于开发一种可以在遭遇破坏后自行修复的塑料或者其他类型的建筑材料。White在采访中表示:“汽车或飞机上的塑料或金属零件如果遭到外界碰撞,那么产生的裂痕就会损害汽车或飞机的使用寿命,而这种裂痕通常不易从外表上发现,这样就会给人们的生命安全带来威胁。”此前,White和他的同事Nancy寻找到了解决这个问题的良方。首先,他们利用3D打印机创建出一种充满微胶囊的新材料,而这种新材料的微胶囊里则充满了特殊的愈合剂。当材料受到磨损时,微胶囊就会打开并释放愈合剂。这种愈合剂实际上是由单体、塑料分子组成的。当愈合剂接触到材料中的其他化学物质时,它就会发生一系列化学反应,从而修复潜在裂缝。
水牛城大学团队研发灌注双性抗霉素B(Amphotericin B)药物的3D打印假牙,将抗霉药物加入丙烯醯胺(Acrylamide)作为打印材料,在3D打印过程中经由针管泵系统将假牙聚合物与微球结合在一起。发现薄膜单层的渗透性较复层好,更能有效抑制霉菌生长。研究团队透过抗挠强度测试机器弯折假牙,进行牙齿强度测试找出断裂点,发现3D打印假牙的抗挠强度比传统方式建造的假牙低35%,但却不会碎裂。药物投放时,抗霉剂先被置入可生物分解及可渗透的微球内,以防药物在高温打印过程中受到影响,在微球逐渐分解同时释出药物。
3D打印假牙可望改善因假牙感染导致的口腔发炎症状。以3D打印微胶囊式消炎药为原材料制成假牙后,它可定期释出抗霉药剂,降低霉菌生长,且假牙还能继续配戴,将为患者省下大量时间与金钱,并对传统耗时的假牙建模形成冲击。
美国劳伦斯利弗莫尔国家实验室(LLNL)的环境研究员Joshua Stolaroff称,小苏打可以拯救世界。他认为,这种材料可以通过捕捉和封存二氧化碳来保护环境,阻止地球变暖。目前已经开发出一种充满了碳酸钠溶液的微胶囊,并将其装在一个允许二氧化碳通过的聚合物壳中。当碳酸钠与二氧化碳和水接触时,生成碳酸氢钠,这是一种廉价、无毒的碳吸收剂,成本较之前可降低40%左右。
对于肿瘤细胞,3D培养方法在表型和基因型方面能让细胞更接近体内的行为。然而,肿瘤微环境何其复杂,虽然有研究人员将肿瘤细胞与其他细胞如成纤维细胞共培养,也有人建立了血管化模型,但还是有些“单薄”,无法精确模拟肿瘤的转移环境。近日,来自美国明尼苏达大学的研究人员利用3D生物打印技术,构建了一种新型的“精密”的3D体外肿瘤模型,如图10-21所示。可以精确放置活细胞(肿瘤细胞、基质细胞和血管细胞)构建功能性的脉管系统,同时可以放置信号分子并控制其释放来引导肿瘤细胞转移。重要的是,将肿瘤靶向药物导入血管可以进行药物筛选。这个模型几乎完美地动态重现了癌症转移的几个关键步骤包括侵袭、血管内渗和血管生成,对于肿瘤的研究和新型抗癌药物的筛选具有重大意义。
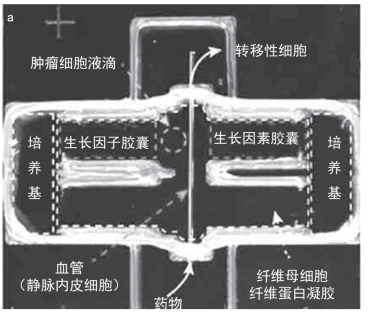
图10-21 3D体外肿瘤模型
该模型有四大模块,可以精确模拟肿瘤转移环境:①肿瘤基质。选择水凝胶作为支架,水凝胶中含有成纤维细胞,用来构成肿瘤基质。②化学环境。3D打印的微胶囊包含趋化通路分子,如VEGF和EGF,在外界刺激下(胶囊外壳响应近红外激光)可动态释放这些化学信号,用来模拟肿瘤组织中的化学环境并指引细胞迁移。③血管系统。将人脐静脉内皮细胞(HUVECs)注入微通道进行内皮化,作为血管导管,以便肿瘤细胞穿过内皮屏障到达血管,产生循环肿瘤细胞(CTCs)。④肿瘤细胞。将肿瘤细胞簇置入打印的液滴隔室,模拟肿瘤的原发部位。
3D材料已经被提议作为扩增干细胞的平台,因为与传统的2D方法相比,这种系统将占用更少的空间来产生同等数量的细胞。伊利诺伊大学芝加哥分校一个由生物工程学研究人员和骨科教授组成的研究小组,开发了一种新的组织、器官3D打印方法。团队制造了一种微流体装置,可产生亚微米级的中空水凝胶球,并以这种微米级的藻酸盐水凝胶材料为细胞的支撑介质,通过3D打印机将细胞沉积到水凝胶材料中,并在内部涂覆一层几微米厚的重构细胞外基质(Extracellular Matrix,ECM)这种水凝胶材料对喷嘴移动或细胞喷射所产生的阻力很小,但能够在打印过程中支撑细胞,将它们保持在适当的位置,并使其保持原有的形状,如图10-22所示。连续的ECM层装饰胶囊的内壁,被锚定到藻酸盐凝胶上并模仿细胞壁Iche的基底膜。使用这种方法封装了人类骨髓间充质干细胞(hMSCs)。将hMSCs直接3D生物打印到微凝胶支持介质中后,微凝胶的光交联可以为构建长期培养的hMSCs提供机械稳定性。
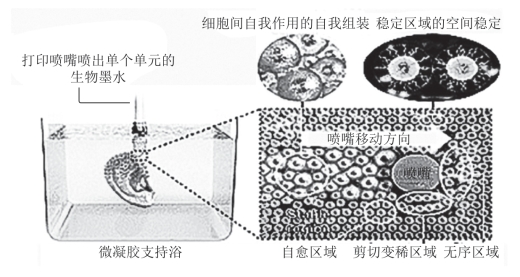
图10-22 藻酸盐微凝胶支撑介质中细胞的3D打印
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




