Ni—MH电池是以金属氢化物为负极,NiOOH为正极,KOH水溶液为电解液的碱性蓄电池。其电化学式为:
(-)M/MH|KOH(6mol/L)|Ni(OH)2/NiOOH(+)储氢合金在电位变化时具有吸氢和释放氢的功能,蓄电池就是利用这种功能实现充放电。
Ni—MH电池在充放电过程中的电极反应如下:
(1)负极反应
正常充放电反应为: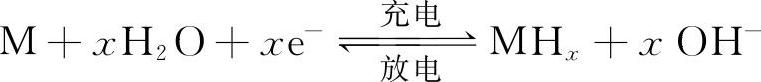
式中,M代表储氢材料,MHx代表金属氢化物,标准电极电势为E0=-0.93V(VS,Hg/HgO)。
过充电反应有:
过放电反应有:
(2)正极反应
正常充放电反应为: (https://www.xing528.com)
(https://www.xing528.com)
标准电极电势为E0=0.39V(VS,Hg/HgO)。
过充电反应为
过放电反应为
这时氢扩散通过隔膜与负极上的M发生如下反应:
(3)电池反应
正常充放电时,电池反应通式可以表示为
标准电池电动势为E0=1.32V。过充电时,电池内部气体发生复合反应,保持电池内部的压力平衡和电池电压稳定,正极上析出氧气,通过多孔隔膜到达负极表面后,与吸附氢原子发生复合反应形成水。由于负极的设计容量过剩,在过充电时,水分子被还原形成吸附氢原子,而不是氢原子复合形成氢分子析出。在上述过程中,镍是良好的催化剂。Ni—MH电池被活化后,储氢合金表面层中金属镍的浓度大大提高,当电池过充电时,吸附在金属镍表面的氢原子增多,有利于复合反应的进行。因此氧气析出也不会影响电池内部的压力。过充电过程中,电池内部的物质没有因为析出氧气而变化,而是通过氧气的析出与反应消耗而达到物质平衡。
根据以上反应可以看出:Ni—MH电池正、负极上所发生的反应均属于固相转变机制,不涉及生成任何可溶性金属离子的中间产物,因此电池的正、负极都具有较高的结构稳定性。此外,Ni—MH电池一般采用负极容量过剩的配置方式,电池在过充时,正极上析出的氧气可在金属氢化物电极表面被还原成水;电池在过放时,正极上析出的氢气又可被金属氢化物电极吸收,从而使得电池具有良好的耐过充过放能力。同时,电池在工作过程中不额外生成和消耗电解液组分(包括KOH和H2O),使得Ni—MH电池可以实现全密封和免维护。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




