最早,人们把与氧结合的反应称为氧化反应,其生成物叫做氧化物,而把从氧化物中去除氧的反应称为还原反应,例如:
氧化反应:2Cu+O2=2CuO
还原反应:CuO+H2=Cu十H2O
自20世纪初建立了化合价的电子理论之后,人们则把失去电子的过程称为氧化,得到电子的过程称为还原。例如在上述氧化反应中,Cu因失去两个电子而与O2结合生成CuO;在还原反应中,CuO中的Cu因得到两个电子而又还原为Cu。然而,在Fe+Cu2+=Fe2++Cu的反应中,电子由Fe转移给了Cu2+,Fe失去电子被氧化,Cu2+得到电子被还原,这里已经没有氧元素的参与。因此,这时的氧化或还原概念已经扩大了。
大多数金属在与空气中的氧、水分、CO2或硫化氢等接触时会被氧化、锈蚀,使其表面形成一层氧化物或者碳酸盐、硫化物等反应物。这类反应物的存在,使液态钎料无法在被焊金属表面润湿、铺展,因此成为影响金属可焊性的重要因素。即使在环境可控的工业条件下,绝大多数金属依然会在空气中被氧化,而对焊接界面的形成,哪怕是极薄的氧化膜也可能成为润湿的障碍。同时,氧化层的导热性也比金属的差,焊接加热时会成为传热的障碍,由此增加了装联组件上的温度梯度和带宽。因此,如何在焊接过程中清洁金属表面就成为必须考虑的实际问题。
金属自发性的氧化是一种自然现象,其原理可由热力学第二定律解释。金属的氧化速率则与其周围的环境因素有关。这里的“环境”涉及焊接时周围的气体(气氛)、温度和助焊剂等。
金属单质在常温、常压的空气中是不稳定的,其稳定性按Al、Zn、Fe、Cu、Ni、Ag、Sn、Pb、Au的顺序依次增强,即位置越靠前的金属越容易失去价电子而与氧结合生成离子价的氧化物。金属氧化可以自发进行这一过程还可由热力学第二定律从宏观上加以说明。
热力学第二定律表达了自发过程进行的可能性、方向和限度。应用热力学第二定律进行判断时,常使用吉布斯自由能判据。该判据指出,在等温、等压且不做其他功的条件下,若任其自然,则自发过程总是向着系统吉布斯自由能减少的方向进行,直到减至该情况下所允许的最小值时,系统则达到平衡,即
ΔG≤0
式中,G为系统的吉布斯自由能(Gibbs Free Energy),也称吉布斯函数,它是系统的状态函数,表达了系统的性质。ΔG为系统由一个状态自发地变化到另一个状态时,吉布斯自由能的变化值(ΔG<0),它只取决于系统的始态和终态,与变化过程无关。式中等号可作为系统达到平衡时的标志。
在用上述判据分析金属的氧化现象时可以发现,常见金属的氧化过程都伴随着吉布斯自由能的降低,因此氧化是可以自发进行的。表3-1列出了常见金属在25℃氧化时的吉布斯自由能的变化值。ΔG还可看做是金属氧化物中,金属与氧结合强度的度量,因此也就代表了金属氧化物的稳定性。ΔG值越大,说明金属氧化物越稳定,也就越不容易被分解,包括用物理方法解除氧化物与底层金属的连接,或用化学方法解除氧离子与金属离子的结合都越困难。由此可知,Al的氧化物很稳定,而Au、Pt(表中未列出其ΔG值)的氧化物的稳定性就很差。因此,除了金、铂等之外,大多数金属在空气中的氧化是不可避免的。Au在室温空气中难以形成稳定的氧化物,因此电极常以镀Au的方式来提高焊接性。
表3-1 常见金属在25℃氧化时的吉布斯自由能的变化值

许多金属常有多种氧化物形式,其稳定性也不同,例如Cu的氧化物有CuO和Cu2O。而且,合金的氧化物常不是纯金属氧化物的简单组合,而可能是新的或其他混合形式的氧化物,其成分与结构也很复杂。
除了氧化物外,实际金属的表面结构也是相当复杂的。通常情况下,从表面开始的几埃到十几埃是气体吸附层,接下来是十几埃至几百埃的氧化膜,再下来是0᥊1μm量级厚度的因摩擦产生的非匀质性微结晶层,最后还有因加工产生的塑性变形层等。可就氧化层来看,也因具体金属而异。
氧化膜一旦形成以后,继续氧化即氧化膜的增厚需要通过原子或电子、离子在氧化膜中的固态扩散迁移来进行。在膜内,反应物质的扩散模型如图3-1所示。图3-1a中只有金属离子M2+向外扩散,并在氧化膜与气体的界面上进行反应,如铜的氧化过程属于这种形式;图3-1 b中只有O2向内扩散,并在金属与氧化膜的界面上进行反应,如钛、锆等金属的氧化;图3-1c氧化过程中金属离子M2+向外扩散和氧离子O2-向内扩散同时进行,并在氧化膜内相遇进行反应,如钴的氧化过程。
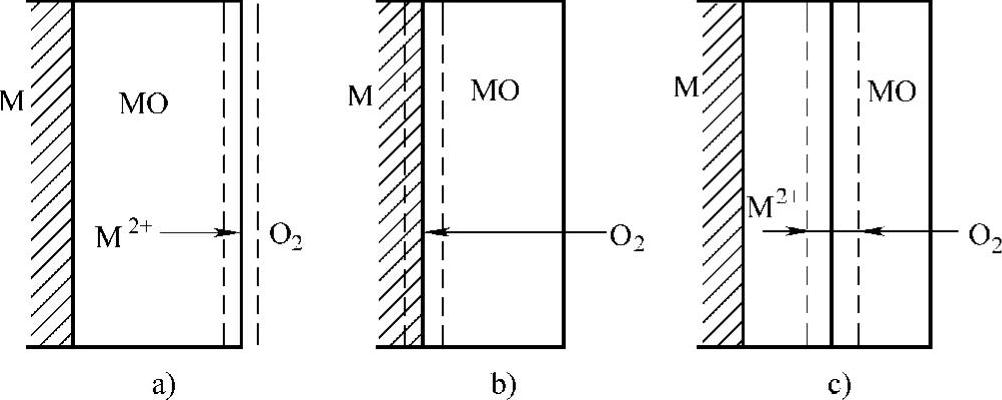
图3-1 氧化过程中金属离子和氧离子的扩散模型
根据不同的金属体系和氧化温度,反应物质在膜内的传输又可以分为以下三种途径:
1)通过晶格扩散,通常在温度较高、氧化膜致密且在氧化膜内部存在高浓度的空位缺陷的情况下,反应物质在膜内主要发生晶格扩散,如钴的氧化。
2)通过晶界扩散,通常是在较低温度下,由于氧化物的晶粒尺寸较小,晶界面积较大,且晶界扩散所需的激活能小于晶格扩散的激活能,使晶界扩散更加容易进行,此时反应物质在膜内主要发生晶界扩散,如镍、铬、铝的氧化。
3)同时通过晶格和晶界扩散,如钛、锆、铪长时间在中温区(400~600℃)的氧化。值得注意的是,当金属离子沿着氧化膜的晶界从内向外扩散时,相当于金属离子空位向金属与氧化膜的界面迁移,这些空位会产生聚集,如果氧化膜太厚而不能通过变形来维持与金属基体的接触,最后在金属与氧化膜的界面将形成孔洞。若金属离子通过晶界扩散的速度大于晶格扩散的速度,则晶界就成为连接孔洞与外部环境的显微通道,使氧分子向内部迁移大于晶格扩散的速度,则晶界就成为连接孔洞与外部环境的显微通道,使氧分子向内部迁移而在孔洞的内表面产生氧化,形成内部多孔的氧化层。
图3-2显示了Cu氧化层的生成机制。Cu的表面是一层CuO,其次是一层Cu2O,最下面为Cu。

图3-2 Cu氧化层的生成机制
其生成机制是:
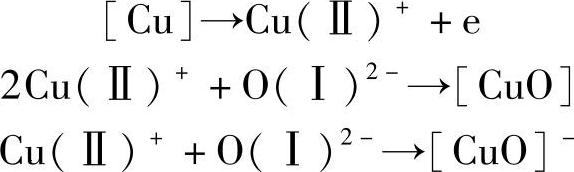
热力学第二定律指出了自发过程的方向性和限度,但没有说明氧化反应的速率问题。由于金属总是不能脱离具体的存储或加工环境,因此环境温度和氧含量等对氧化起着至关重要的作用。例如,像蒸镀膜那样的无氧化金属表面,在1×10-6×133Pa的真空条件下,仅1s的时间就能在许多金属表面形成单分子层厚度的氧化膜。(https://www.xing528.com)
氧化层厚度对金属可焊性有直接的影响,而可焊性又与微电子焊接缺陷水平直接相关,由此也就可以建立氧化层厚度与焊接缺陷水平的联系。图3-3显示了在空气中,采用非活性助焊剂焊接时,Cu基板的氧化层厚度对PCB组件焊接缺陷水平的影响。由此可见,最初的5nm氧化层厚度对金属的可焊性与焊点缺陷水平有至关重要的影响。因此,需要考虑影响氧化层生长的因素。

图3-3 Cu基板的氧化层厚度对PCB组件焊接缺陷水平的影响
影响金属表面氧化层厚度的主要因素是其暴露在空气中的时间和环境温度。图3-4显示了室温时,经机械方式清洁后的Cu、Ni和Al表面,其氧化层生长厚度随时间变化的情况。由图3-4可见,Cu、Ni表面几乎在空气中几分钟内就能形成5nm以上的氧化层,而Al也只需不到10min的时间就能生成近乎同样厚度的氧化层。通常情况下,温度每升高25℃,氧化速度就大约增加一倍,于是,那些稳定的氧化物会变得更厚、更黏。图3-5显示了温度对Cu、Ni表面氧化层厚度的影响(在相关温度下的时间大约是数分钟)。由于氧化层的生长速度很快,因此,通常都要求在清洁完金属表面之后立即进行焊接,并且以尽可能快的速度完成整个加热、焊接过程。对禁止采用助焊剂的场合,给金属表面镀金也就成为提高其可焊性的重要选择。此外,氧化层的生长率还与金属的表面粗糙度、残余应力以及空气中的含氧量和空气湿度等有关。例如,具有粗晶粒显微组织的金属表面更容易形成连续分布的氧化层结构,这样的金属表面也就更容易失去焊接性。

图3-5 氧化层厚度与温度的关系
钎料同样易被氧化。钎料是一种合金材料,作为一次近似,其氧化层厚度近似
与时间t1/2成正比,其关系可近似为一般的扩散型方程:
x2=Dt=D0te(-Q/RT)
式中x——氧化层厚度;
D——扩散率;
t——氧化时间(s);
D0——扩散系数(m2/s);
T——金属材料的温度(K);
Q——激活能(J/mol);
R——通用气体常数[8.314J/(mol·K)]。
对纯锡,Q=33kJ/mol,D0=3.7×10-18m2/s;对锡铅共晶钎料,Q=40kJ/mol,D0=25×10-17m2/s。对固态钎料,其新鲜表面会在极短时间内就达到纳米级的氧化层厚度,在加热环境下(如焊接场合),这一增长速度更快。因此,从预防氧化的角度出发,一般都考虑在惰性气氛或使用助焊剂来防止钎料的高温氧化。
钎料合金的氧化物常常是其组成元素氧化物的混合体,并且其组成元素的氧化物越稳定(ΔG值越大),这类元素在钎料表面也就越容易被氧化,在合金的氧化物构成中这类元素的氧化物水平也就越高。因此,即使是Sn95Pb这样的高Pb钎料,合金表面Sn的氧化物也要比Pb的高出许多倍。由表3-1可知,In、Zn氧化物的稳定性是超过了Sn的。因此,对大多数钎料合金其表面氧化物主要是Sn的氧化物,而只有In系和Zn系钎料的氧化物与此不同。这也是大多数锡基钎料可使用类似的助焊剂,而后两类钎料需要不同的助焊剂的原因。
从可焊性角度出发,5nm厚的氧化层就能对焊接质量产生明显影响。这时,多数金属的氧化速率都是很快的。作为金属氧化的一般性考虑,其实许多金属在自然条件下的氧化还是很慢的。例如,许多金属如Al表面形成一层致密的氧化膜之后,又往往保护了内部金属,从而也就极大地降低了氧化速度。温度升高加剧了金属的氧化速度,并在高温环境还可能出现常温下不易形成的氧化物。例如在488℃以下,铅的氧化物主要是PbO,当加热到800K时,将得到红色的Pb3O4。表3-2总结了常见的几种金属的氧化特点。大气污染严重时,空气中的二氧化硫、硫化氢以及包含了氮粒子的水分等都能加剧许多金屑的腐蚀,如二氧化硫对于Fe、Zn、Ni,硫化氢对于Ag、Au,氨对于Cu等。
表3-2 常见的几种金属的氧化特点
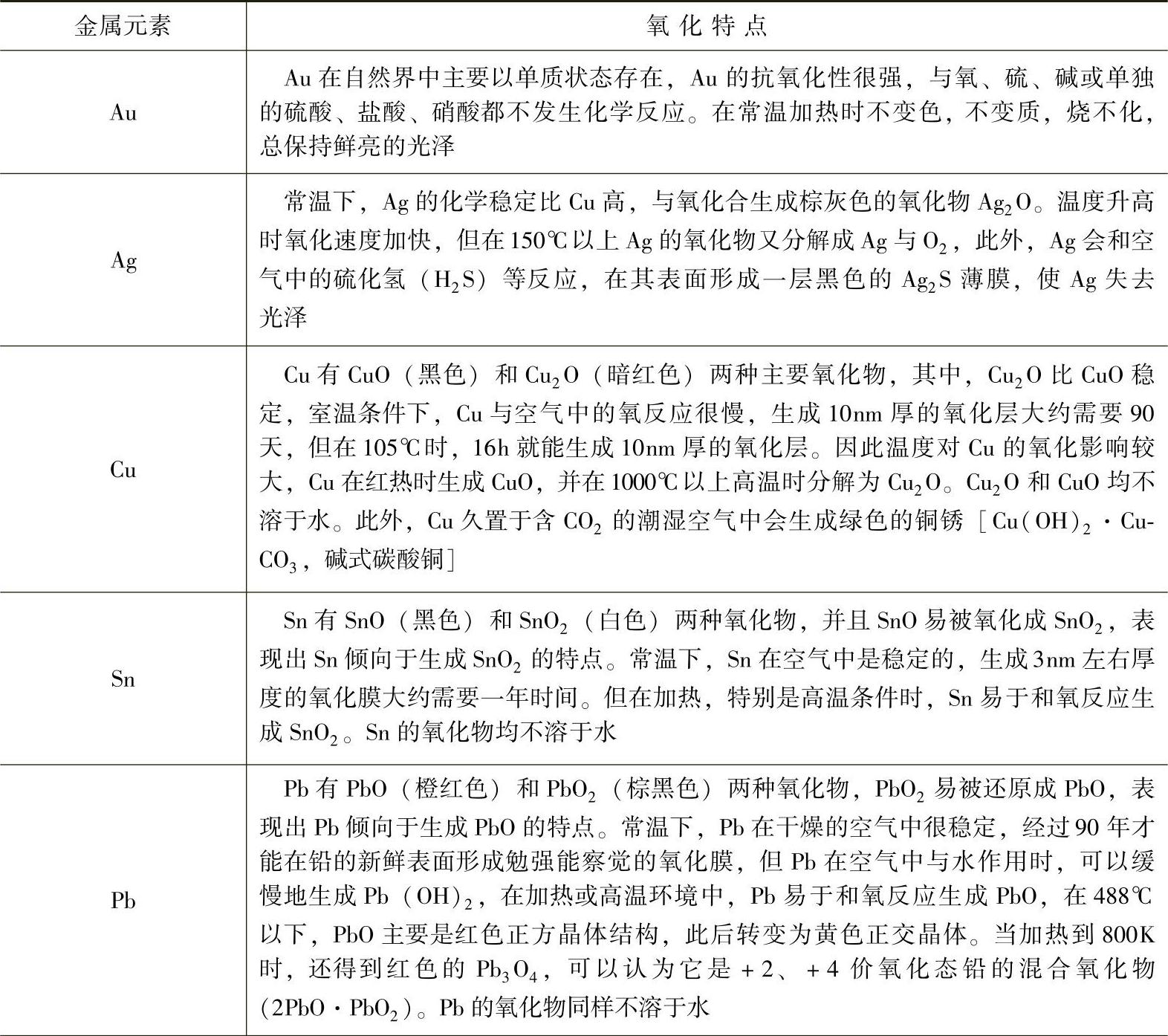
(续)

若考虑氧化物的性质,则Sn与Pb的一氧化物两性偏碱、二氧化物则两性偏酸,Zn和Al的氧化物是两性氧化物,Cu、Ag和Fe的氧化物则是碱性氧化物。通常,两性氧化物与酸碱反应生成盐,碱性氧化物与酸反应生成盐。
总之,除了钎料合金与金属基板在存储中的氧化、锈蚀外,焊接时的预热和高温都增加了材料的氧化倾向。氧化层的存在使液态钎料无法直接润湿金属表面并生成预定的界面层,钎料的氧化还破坏了钎料纯度、恶化了钎料性能。例如波峰焊中,熔融的锡铅钎料由于不断地被搅动,氧化速度很快,不断生成的氧化物包裹钎料并形成锡渣,从而使这部分钎料失效。因此氧化对焊接十分有害。

图3-6 表面氧化膜质量Δm随时间t的变化关系
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




