理想的止血材料能够迅速停止动脉和静脉大量流血,甚至可应用于血泊止血,并且轻便、耐用、在不同温度和湿度下稳定、不会对受伤者和施救者造成伤害。壳聚糖具有无毒、无抗原性、生物相容性、抑菌、促进伤口愈合以及易于形成凝胶等特性,具备止血材料应该拥有的各种优良性能。国内外大量研究结果已经证实了壳聚糖优良的止血性能。
壳聚糖可以加工成粉末、溶液、凝胶、薄膜、海绵、纤维等多种形式的材料后用于伤口止血。自Malette等于1983年首次发表壳聚糖止血功能的研究后,以壳聚糖为原料制备的止血材料及止血性能越来越受到人们的关注,目前有多种形态和种类的止血材料应用于伤口出血治疗。壳聚糖的止血效果与其相对分子质量、脱乙酰度、质子化程度和物理形式等密切相关。当壳聚糖纤维与血液接触时,白蛋白、Y-球蛋白、血纤维蛋白原和凝血原酶等血浆蛋白迅速吸附在纤维表面,介导了血小板在材料表面的黏附。随后,血小板发生形变并被激活,同时引起包括β-血小板球蛋白、5-羟色胺、腺苷核苷酸和促凝血激活物等血小板内容物的释放。其中,腺苷核苷酸能促使更多的血小板在纤维表面的黏附,最终形成的血小板聚集体和不溶性血纤维蛋白以及被截留的血细胞共同形成血栓。黏多糖、磷脂及细胞外基质蛋白等许多生物大分子显负电性,在pH≤6.8的环境中,壳聚糖质子化而显正电性,壳聚糖的血栓形成能力部分归结于它与生物大分子之间的静电作用。图9-3显示壳聚糖在弱酸条件下质子化的示意图。
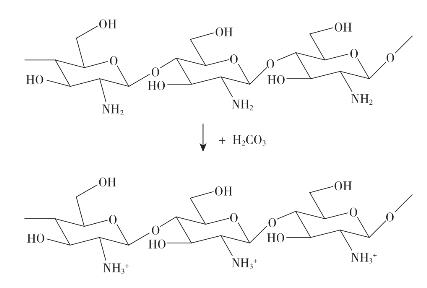
图9-3 壳聚糖在弱酸条件下质子化的示意图(https://www.xing528.com)
血小板是血液凝固中的主要成分,可被多种异物材料活化后介导凝血过程,同时释放出多种促进伤口愈合的细胞因子。壳聚糖纤维对血小板的黏附聚集作用与其分子链上很高的正电荷密度相关,血小板活化后,其表面出现的大量呈负电性的磷脂酰丝氨酸与壳聚糖发生静电吸引,在中和壳聚糖的正电荷后,血小板的黏附数目急剧下降。在血小板的活化和聚集过程中,Ca2+是决定血小板功能最主要的次级信号之一,吸附到壳聚糖材料上的血小板细胞内液中Ca2+含量明显提高,其提高程度与壳聚糖的用量有关。
Segal等在研究海藻酸盐纤维的止血性能时发现海藻酸盐纤维的止血性能主要源于凝血效应和对血小板的激化作用,海藻酸盐纤维释放出的Ca2+在激化血小板后使其释放出纤维蛋白链而形成血栓,因此产生良好的止血功效。对于壳聚糖纤维,马军阳等的研究显示,壳聚糖通过蛋白质介导黏附血小板后形成的壳聚糖与血小板复合物,可以加速血纤维蛋白单体的聚合并共同形成凝块。与此同时,壳聚糖通过诱导红细胞聚集刺激血管收缩,最终形成血栓后封合伤口。在血栓形成过程中起重要作用的细胞因子包括白细胞介素(IL)、肿瘤坏死因子(TNF)、转化生长因子(TGF)等。
高金伟等研究了壳聚糖纤维对肝脏的止血效果,试验组使用壳聚糖纤维贴敷创面,对照组使用可吸收止血纱布(速即纱,是由美国强生公司生产,由再生氧化纤维素制成,其性质如织物),空白组不使用任何材料,术后记录各组的总出血量和止血率。结果显示,试验组、对照组和空白组的止血率分别为100%、25%和0%,出血量分别为(0.443±0.030)g/kg、(0.702±0.056)g/kg和(2.121±0.190)g/kg,壳聚糖纤维敷料的止血效果明显优于对照组和空白组。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




