8.3.2.1 溶液pH值对材料吸附Cu(Ⅱ)、Pb(Ⅱ)的影响
如图8-7所示,可以发现溶pH值对吸附效果的影响很大,随着溶液pH值的增大,吸附量明显增大,但是由于Cu(Ⅱ)、Pb(Ⅱ)在碱性条件下会发生水解,所以不能选择在碱性溶液中进行试验,在本试验以后的吸附过程中选择pH=5作为最佳的试验条件。
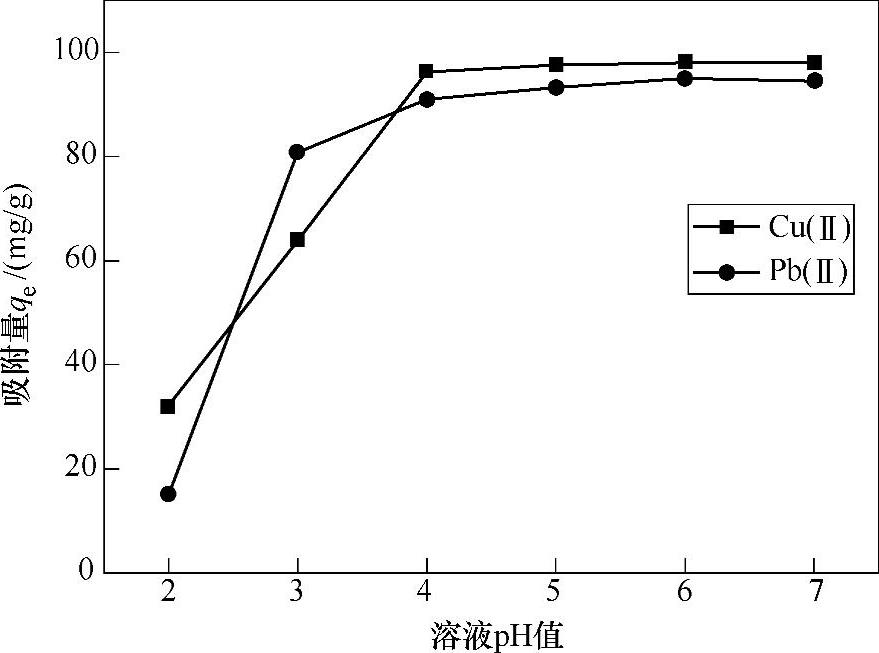
图8-7 溶液pH值对吸附量的影响
8.3.2.2 材料添加量对吸附效果的影响
从图8-8中可以发现,对Cu(Ⅱ)和Pb(Ⅱ)产生最佳吸附时所需要的材料量是不一样的,但是吸附率却都随着材料用量的增大而达到了一个稳定的趋势。为保证在最少的材料用量情况下可以达到一个较好的吸附效果,在后续的试验中,选择用15mg和30mg的材料分别来吸附Cu(Ⅱ)和Pb(Ⅱ)。此时,对Cu(Ⅱ)的吸附率可以达到98.5%,吸附量为66mg/g;对Pb(Ⅱ)的吸附率可以达到91%,吸附量为60.5mg/g。
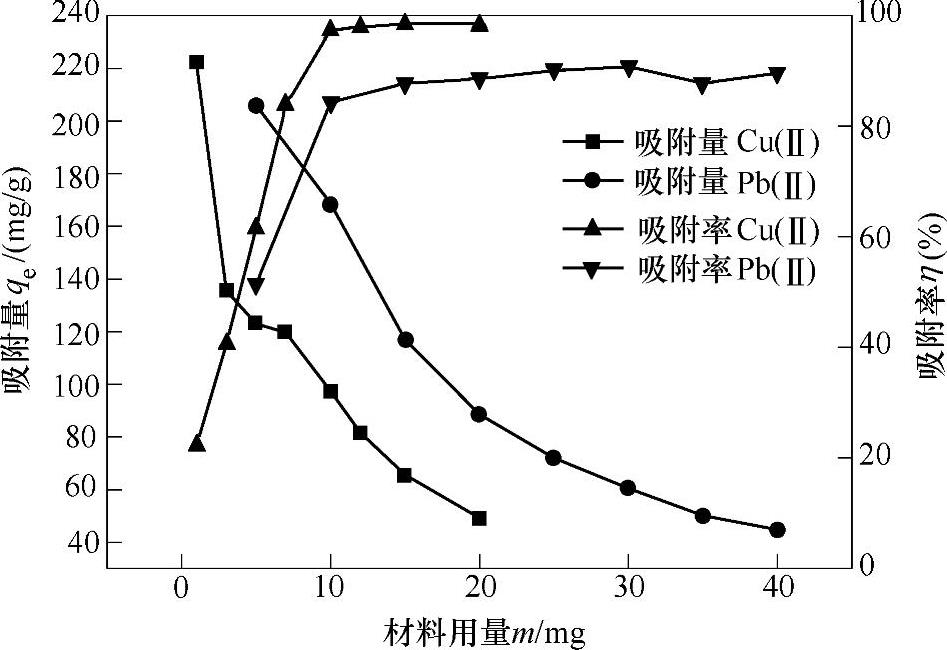
图8-8 材料用量对吸附率和吸附量的影响
8.3.2.3 振荡时间的影响
从图8-9可以看到,随着振荡时间的增加,吸附量并没有随着增加,表明Cu(Ⅱ)和Pb(Ⅱ)在材料加入很短的一段时间内已经被吸附,这同时也说明材料的吸附性特别好,吸附瞬间即可达到平衡。试验中材料对Cu(Ⅱ)和Pb(Ⅱ)的吸附量分别可以达到63mg/g、62mg/g。
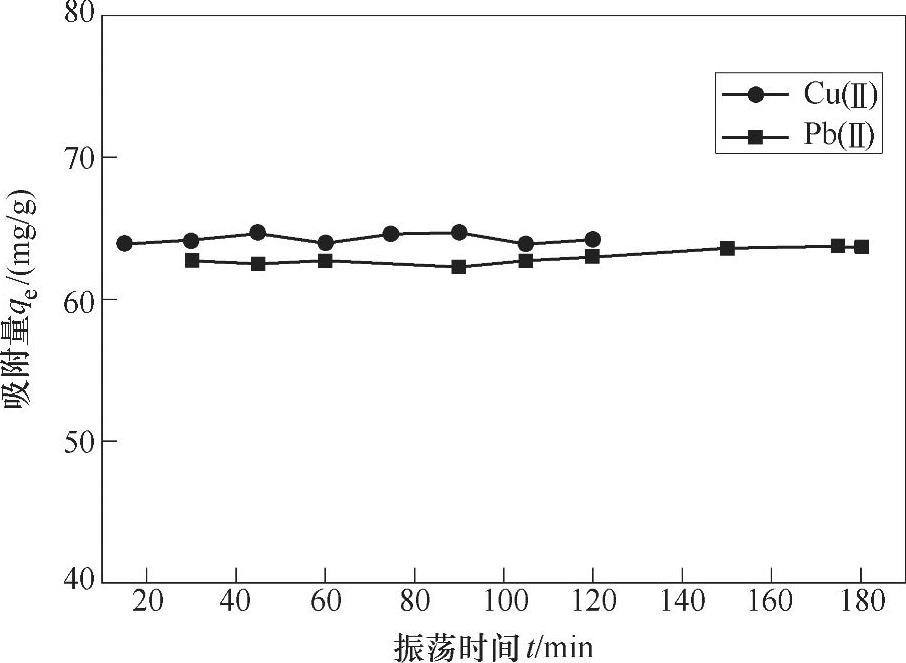
图8-9 振荡时间对吸附量的影响
8.3.2.4 饱和吸附量的测定
Fe3O4@NH2@MOF-5对Cu(Ⅱ)和Pb(Ⅱ)的吸附符合Langmuir吸附模式,即
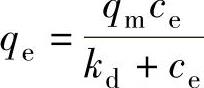
式中 ce——吸附后的浓度(mg/L);
qe——吸附量(mg/g);
qm——最大吸附量(mg/g);(https://www.xing528.com)
kd——吸附平衡常数。
以1/ce为横坐标,1/qe为纵坐标作图,结果如图8-10b所示。1/qe和1/ce之间呈线性关系,其线性方程为
1/qe=0.01968/ce+0.00562
通过该线性方程计算可以得到qm=177.94mg/g,即Fe3O4@NH2@MOF-5对Cu(Ⅱ)的吸附在优化之后理论上可达到177.94mg/g。
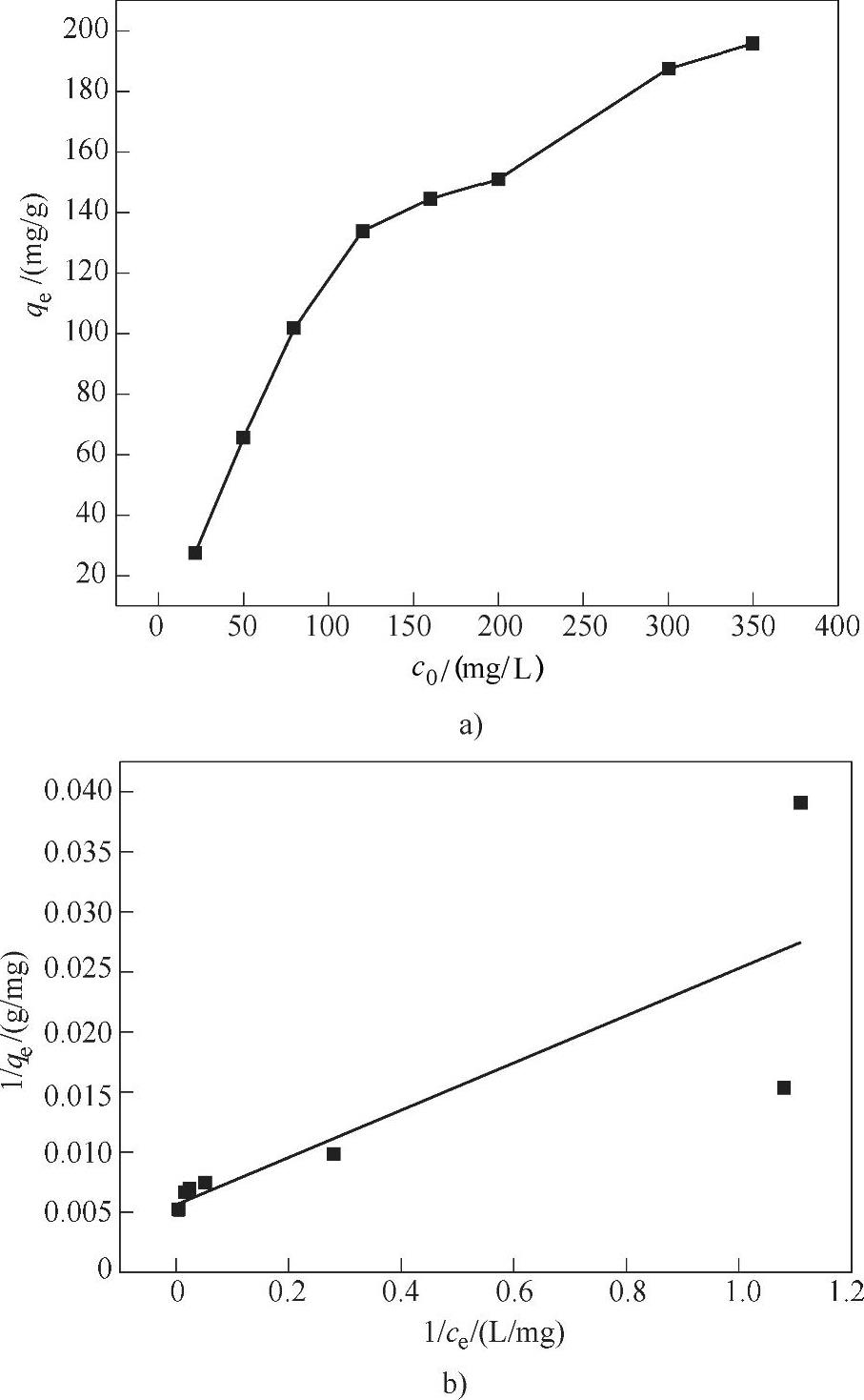
图8-10 Fe3O4@NH2@MOF-5对Cu(Ⅱ)吸附容量的测定
a)Fe3O4@NH2@MOF-5对不同初始浓度Cu(Ⅱ)的吸附曲线 b)1/ce与1/qe之间的线性关系
同理,从图8-11b也可以得到1/qe和1/ce之间的线性方程为
1/qe=0.15453/ce+0.00109
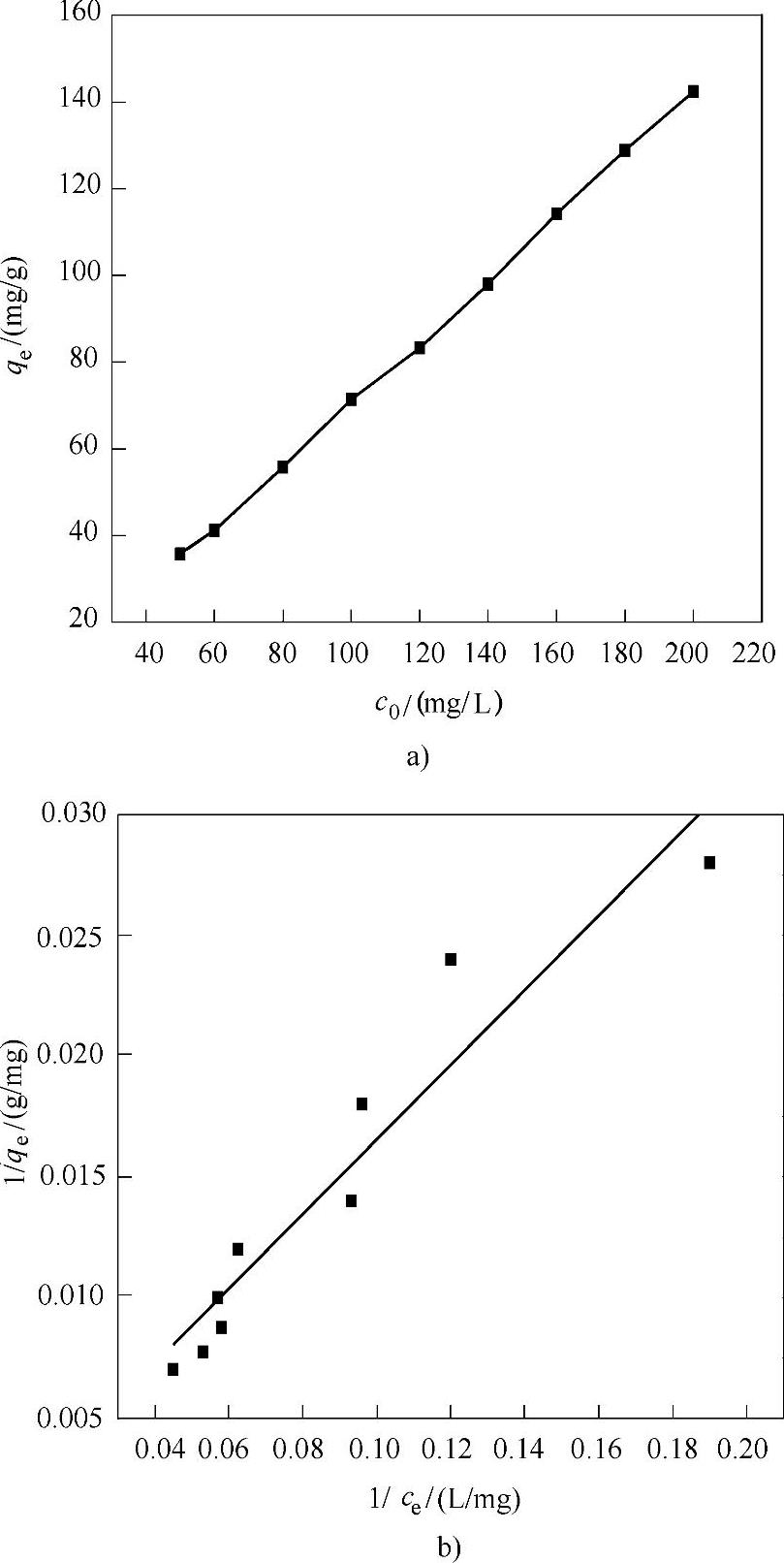
图8-11 Fe3O4@NH2@MOF-5对Pb(Ⅱ)吸附容量的测定
a)Fe3O4@NH2@MOF-5对不同初始浓度的Pb(Ⅱ)的吸附曲线 b)1/ce与1/qe之间的线性关系
通过该线性方程计算可得到Fe3O4@NH2@MOF-5对Pb(II)的理论吸附量可达到917.4mg/g。
8.3.2.5 洗脱液的选择
通过单因素试验,探究出了最佳的试验条件,然后将最佳吸附条件下吸附了金属离子的Fe3O4@NH2@MOF-5用去离子水清洗,清洗完成后向吸附剂中加入10mL洗脱液,超声处理后于水浴中振荡1h,然后用磁铁将吸附剂分离出来,最后用原子吸收分光光度计测定上层清液中金属离子的浓度,计算洗脱率。本试验分别研究了盐酸、硝酸、乙酸和EDTA对金属离子的洗脱效果,数据表明,EDTA溶液对Cu(Ⅱ)的洗脱效果好,而盐酸溶液对Pb(II)的洗脱效果较好,如图8-12所示。
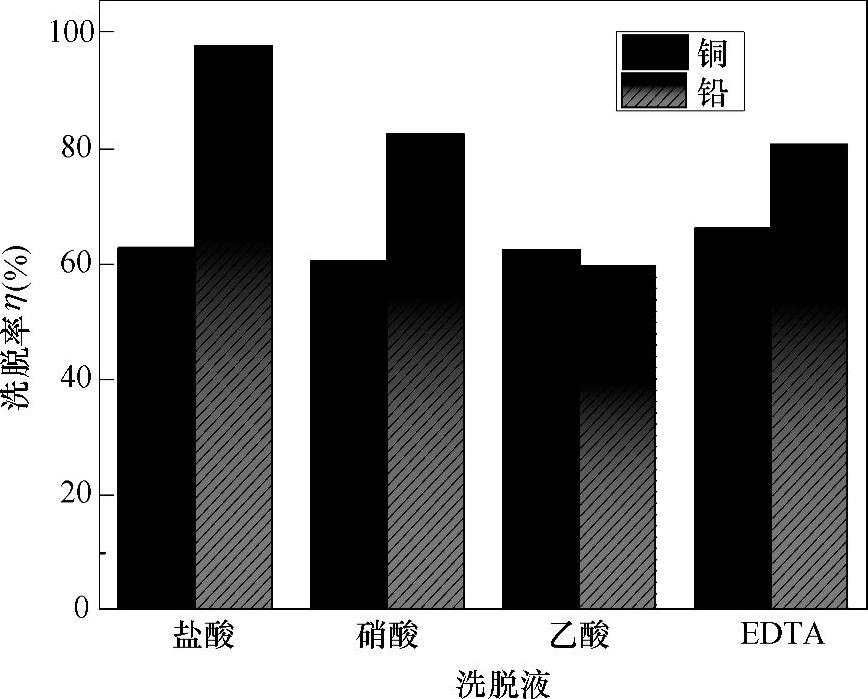
图8-12 不同洗脱液对Cu(Ⅱ)和Pb(Ⅱ)的洗脱效果
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




