7.3.4.1 吸附等温线
配制浓度为50mg/L、60mg/L、80mg/L、100mg/L、120mg/L的Pb2+溶液各250mL。将各浓度的溶液各取25mL三份,加入35mgFe3O4@C@PAM,调节pH值为6,分别在298K、308K、318K的恒温水浴中振荡75min进行吸附,振荡后用磁铁吸住磁性材料,取上层清液过滤,测其吸光度A,结果见表7-9~表7-11。
表7-9 298K时吸附等温线试验数据
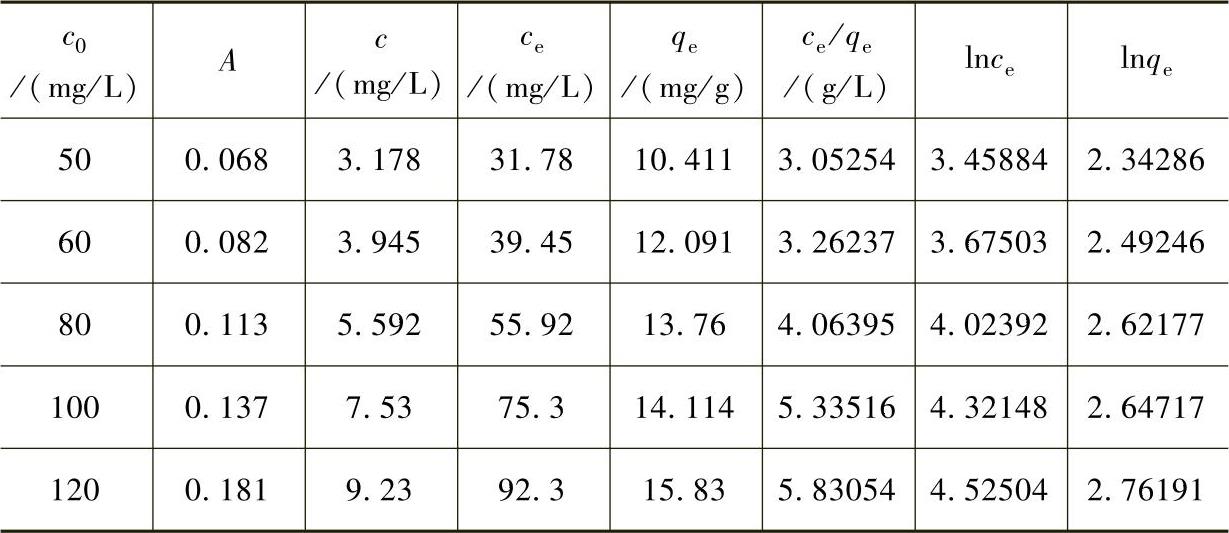
表7-10 308K时吸附等温线试验数据

表7-11 318K时吸附等温线试验数据
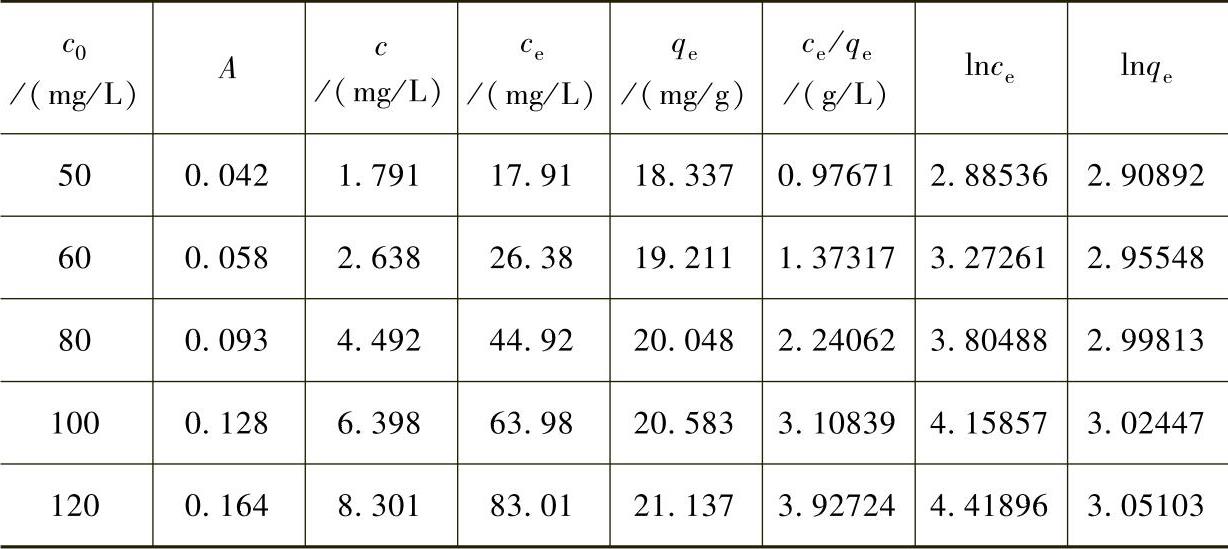
根据式(7-1)算出吸附量qe,以c0为横坐标,qe为纵坐标,做不同温度下的吸附等温线,如图7-10所示。

图7-10 吸附等温线
由图7-10可见,吸附量随着Pb2+溶液初始浓度的增大而增加,吸附量随着温度的升高而升高,表明吸附为吸热过程。7.3.4.2 吸附热力学模型
以ce/qe对ce作图,得图7-11。
由图7-11可得,298K时Fe3O4@C@PAM吸附Pb2+的Langmuir模型拟合曲线方程为
ce/qe=1.42113+0.04898ce (7-2)
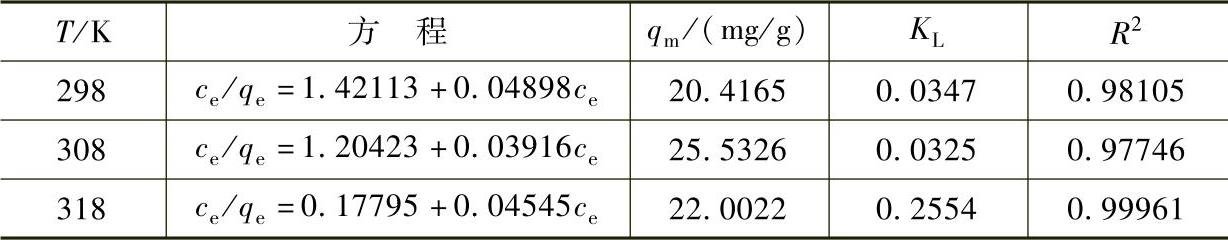
R2=0.98105,根据式(7-2)可求得qm=20.4165,KL=0.0347。同理可求得各个温度下Fe3O4@C@PAM吸附Pb2+的Langmuir模型拟合曲线方程,结果见表7-12。
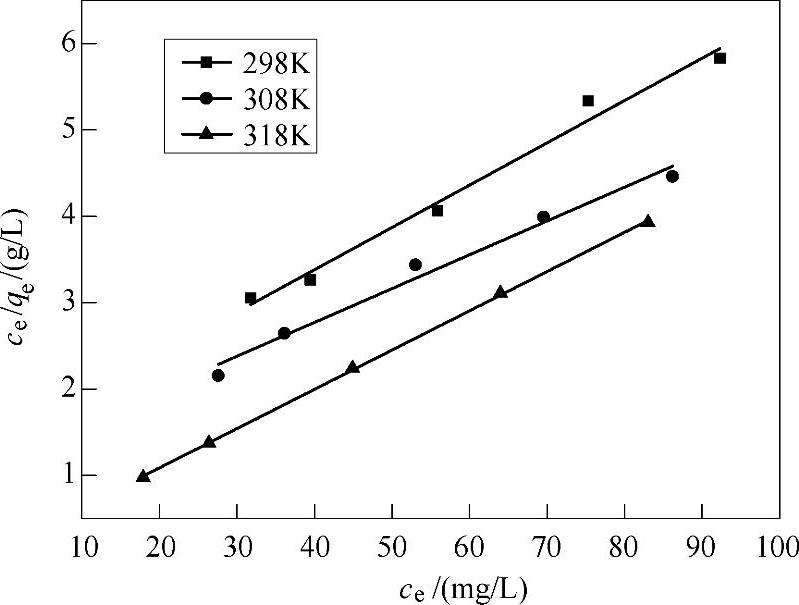
图7-11 Langmuir模型拟合曲线
表7-12 Fe3O4@C@PAM吸附Pb2+的Langmuir模型拟合曲线方程
以lnqe对lnce作图,得图7-12。

图7-12 Freundlich模型拟合曲线
由图7-12可知,298K时Fe3O4@C@PAM吸附Pb2+的Freundlich模型拟合曲线方程为
lnqe=1.15959+0.35334lnce (7-3)
R2=0.92387,根据式(7-3)可求得n=2.8301,Kf=3.1886。同理可求得各个温度下Fe3O4@C@PAM吸附Pb2+的Freundlich模型拟合曲线方程,结果见表7-13。
表7-13 纳米Fe3O4@C@PAM粒子吸附Pb2+的Freundlich模型等温方程参数
 (https://www.xing528.com)
(https://www.xing528.com)
由表7-13中数据可知,所研究的浓度和温度范围内,Fe3O4@C@PAM吸附Pb2+的过程较好地符合Langmuir模型(R2>0.97),说明吸附为单分子层吸附,主要是化学吸附。Langmuir吸附等温方程中的吸附系数KL随着温度和吸附热的改变的变化关系式为
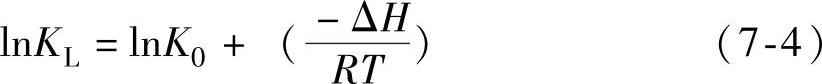
式中 ΔH——吸附焓变;
R——理想气体常数;
T——热力学温度;
K0——常数。
Langmuir吸附热系数随温度变化的数据见表7-14。
表7-14 Langmuir吸附热系数随温度变化的数据

以lnKL对1/T作图,如图7-13所示。

图7-13 Fe3O4@C@PAM吸附Pb2+的吸附热力学 拟合回归方程示意图
由图7-13可以得到
lnKL=-9348.65747/T+27.65694 (7-5)
R2=0.41731,通过斜率-ΔΗ/RT可求得ΔH=77.7247kJ/mol。
熵的变化可由吉布斯自由能方程(ΔG=-nRT)计算得到。

式中 ΔS——熵变[kJ/(mol/K)];
ΔG——吸附吉布斯自由能变(kJ/mol)。
根据式(7-6)计算Fe3O4@C@PAM对Pb2+吸附自由能变和熵变。
ΔG=-nRT=-2.8301×0.008314×298kJ/mol
=-7.0118kJ/mol
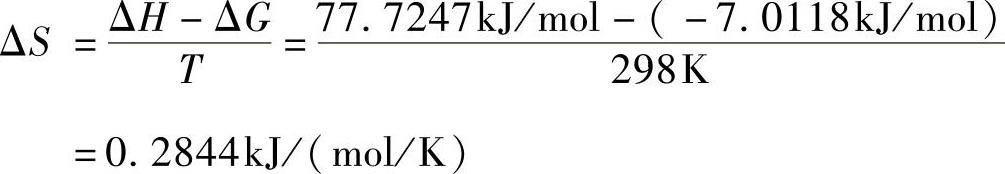
同理可求得各个温度下的焓变、吸附自由能变和熵变,见表7-15。
表7-15 Fe3O4@C@PAM吸附Pb2+的焓变、自由能变和熵变
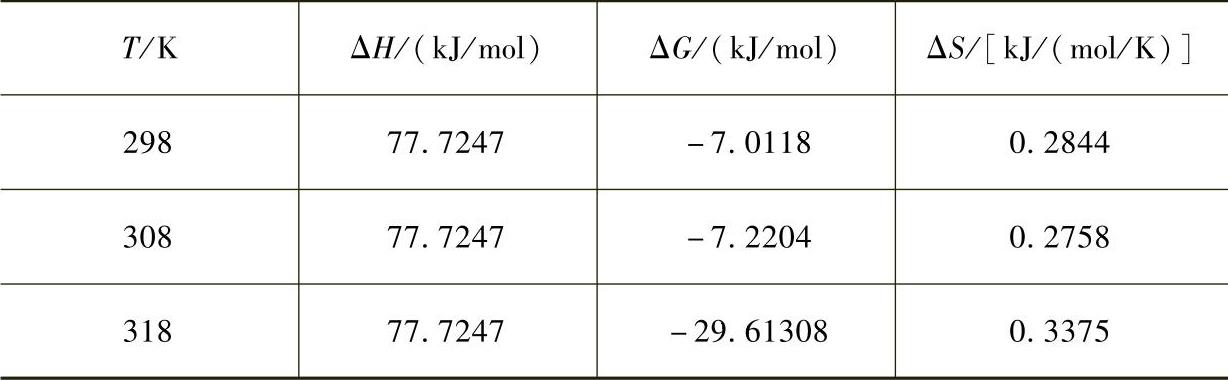
由表7-15可以看出,Fe3O4@C@PAM吸附Pb2+的过程ΔH>0,表明吸附反应属于吸热反应,升高温度有利于吸附;ΔS>0,表明吸附过程是一个无序的熵增过程;自由能ΔG<0,表明该过程是自发的。从以上分析可以得出,Fe3O4@C@PAM吸附Pb2+的过程是一个自发的、无序的、吸热的化学吸附过程,升高温度对吸附有利。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




