蛋白质是生命的物质基础,一切有生命的东西都含有不同类型的蛋白质。蛋白质又是食品的重要组成之一,也是食品中重要的营养素指标。它是复杂的含氮有机化合物,其溶液是典型的胶体分散体系,由两性氨基酸以肽键相互联接而成。蛋白质可以用酶、酸或甲硫水解,最终水解产物为氨基酸,其中赖氨酸、色氨酸、亮氨酸、异亮氨酸、苯丙氨酸、甲硫氨酸、苏氨酸和缬氨酸在人体内不能合成,被称为必需氨酸,它们对人体起很重要的生理功能作用。
食品的种类很多,其中蛋白质含量也不同,特别是其他成分,如碳水化合物、脂肪和维生素的干扰很多,因此,蛋白质的测定通常利用经典的凯氏定氮法。食品中氨基酸的测定,主要采用氨基酸自动分析仪测定法。
(一)凯氏定氮法
1.原理
食品中的蛋白质在催化加热条件下被分解,产生的氨与硫酸结合生成硫酸铵。碱化蒸馏使氨游离,用硼酸吸收后以硫酸或盐酸标准滴定溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质的含量。
2.试剂
浓硫酸;硫酸铜;硫酸钾;氢氧化钠溶液(400g/L);硼酸溶液(20g/L);甲基红指示剂;溴甲酚绿混合指示剂;亚甲基蓝指示剂;95%乙醇;0.1000mol/L盐酸标准溶液。
3.仪器设备
图2-2 定氮蒸馏装置图
1—电炉 2—水蒸气发生器(2L烧瓶)3—螺旋夹 4—小玻杯及棒状玻塞5—反应室 6—反应室外层 7—橡皮管及螺旋夹 8—冷凝管 9—蒸馏液接收瓶
(1)天平。
(2)定氮蒸馏装置 如图2-2所示。
4.操作方法
(1)试样处理 称取充分混匀的固体试样0.2~2g、半固体试样2~5g或液体试样10~25g(约相当于30~40mg氮),精确至0.001g,移入干燥的100、250或500mL定氮瓶中,加入0.2g硫酸铜、6g硫酸钾及20mL硫酸,轻摇后于瓶口放一小漏斗,将瓶以45 °角斜支于有小孔的石棉网上。小心加热,待内容物全部炭化,泡沫完全停止后,加强火力,并保持瓶内液体微沸,至液体呈蓝绿色并澄清透明后,再继续加热0.5~1h。取下放冷,小心加入20mL水。放冷后,移入100mL容量瓶中,并用少量水洗定氮瓶,洗液并入容量瓶中,再加水至刻度,混匀备用。同时做试剂空白试验。
(2)测定 按图装好定氮蒸馏装置,向水蒸气发生器内装水至2/3处,加入数粒玻璃珠,加甲基红乙醇溶液数滴及数毫升硫酸,以保持水呈酸性,加热煮沸水蒸气发生器内的水并保持沸腾。
向接收瓶内加入10.0mL硼酸溶液及1~2滴混合指示液(2份甲基红乙醇溶液与1份亚甲基蓝乙醇溶液,临用时混合。也可用1份甲基红乙醇溶液与5份溴甲酚绿乙醇溶液,临用时混合),并使冷凝管的下端插入液面下,根据试样中氮含量,准确吸取2.0~10.0mL试样处理液由小玻杯注入反应室,以10mL水洗涤小玻杯并使之流入反应室内,随后塞紧棒状玻塞。将10.0mL氢氧化钠溶液倒入小玻杯,提起玻塞使其缓缓流入反应室,立即将玻塞盖紧,并加水于小玻杯以防漏气。夹紧螺旋夹,开始蒸馏。蒸馏10min后移动蒸馏液接收瓶,液面离开冷凝管下端,再蒸馏1min。然后用少量水冲洗冷凝管下端外部,取下蒸馏液接收瓶。以硫酸或盐酸标准滴定溶液滴定至终点,其中2份甲基红乙醇溶液与1份亚甲基蓝乙醇溶液指示剂,颜色由紫红色变成灰色,pH5.4;1份甲基红乙醇溶液与5份溴甲酚绿乙醇溶液指示剂,颜色由酒红色变成绿色,pH5.1。同时作试剂空白。
5.结果计算
试样中蛋白质的含量按下式计算
式中 X——试样中蛋白质的含量,g/100g;
V1——试液消耗硫酸或盐酸标准滴定液的体积,mL;
V2——试剂空白消耗硫酸或盐酸标准滴定液的体积,mL;
V3——吸取消化液的体积,mL;
c——硫酸或盐酸标准滴定溶液浓度,mol/L;
0.0140——1.0mL硫酸[c(1 /2H2SO4)=1.000mol/L]或盐酸[c(HCl)=1.000mol/L]标准滴定溶液相当的氮的质量,g;
m——试样的质量,g;
F——氮换算为蛋白质的系数。一般食物为6.25;纯乳与纯乳制品为6.38;面粉为5.70;玉米、高粱为6.24;花生为5.46;大米为5.95;大豆及其粗加工制品为5.71;大豆蛋白制品为6.25;肉与肉制品为6.25;大麦、小米、燕麦、裸麦为5.83;芝麻、向日葵为5.30;复合配方食品为6.25。
以重复性条件下获得的两次独立测定结果的算术平均值表示,蛋白质含量≥1g/100g时,结果保留三位有效数字;蛋白质含量<1g/100g时,结果保留两位有效数字。
6.说明及注意事项
(1)所用试剂溶液应用无氨蒸馏水配制。
(2)消化时不要用强火,应保持和缓沸腾,以免粘贴在凯氏瓶内壁上的含氮化合物在无硫酸存在的情况下消化不完全而造成氮损失。
(3)消化时应注意不时转动凯氏烧瓶,以便利用冷凝酸液将附在瓶壁上的固体残渣洗下,并促进其消化完全。
(4)样品中若含脂肪较多时,消化过程中易产生大量泡沫,为防止泡沫溢出瓶外,在开始消化时应用小火加热,并时时摇动;或者加入少量辛醇或液体石蜡或硅油消泡剂,并同时注意控制热源强度。
(5)当样品消化液不易澄清透明时,可将凯氏烧瓶冷却,加入30%过氧化氢2~3mL再继续加热消化。
(6)若取样量较大,如干试样超过5g可按每克试样5mL的比例增加硫酸用量。
(7)一般消化至呈透明后,继续消化30min即可,但对于含有特别难以氨化的氮化合物的样品,如含赖氨酸、组氨酸、色氨酸、酪氨酸或脯氨酸等时,需适当延长消化时间。有机物如分解完全,消化液呈蓝色或浅绿色,但含铁量多时,呈较深绿色。(https://www.xing528.com)
(8)蒸馏装置不能漏气。
(9)蒸馏前若加碱量不足,消化液呈蓝色,不生成氢氧化铜沉淀,此时需再增加氢氧化钠用量。氢氧化铜在70~90℃时发黑。
(10)蒸馏完毕后,应先将冷凝管下端提离液面清洗管口,再蒸1min后关掉热源。否则可能造成吸收液倒吸。
(二)分光光度法
食品中的蛋白质在催化加热条件下被分解,分解产生的氨与硫酸结合生成硫酸铵,在pH4.8的乙酸钠-乙酸缓冲溶液中与乙酰丙酮和甲醛反应生成黄色的3,5-二乙酰-2,6-二甲基-1,4-二氢化吡啶化合物。在波长400nm下测定吸光度值,与标准系列比较定量,结果乘以换算系数,即为蛋白质含量。此法具体检测步骤参考GB 5009.5-2010。
本方法适用于食品中的天冬氨酸、苏氨酸、丝氨酸、谷氨酸、脯氨酸、甘氨酸、丙氨酸、缬氨酸、甲硫氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、组氨酸、赖氨酸和精氨酸十六种氨基酸的测定。不适用于蛋白质含量低的水果、蔬菜、饮料和淀粉类食品中氨基酸测定。
1.原理
食品中的蛋白质经盐酸水解成为游离氨基酸,经氨基酸分析仪的离子交换柱分离后,与茚三酮溶液产生颜色反应,再通过分光光度计比色测定氨基酸含量。
2.试剂
浓盐酸;苯酚(须重蒸馏);混合氨基酸标准液;pH2.2的柠檬酸缓冲液;pH3.3的柠檬酸钠缓冲液;pH4.0的柠檬酸钠缓冲液;茚三酮溶液;高纯氮气;冷冻剂(市售食盐与冰按1+3混合)。
3.仪器设备
(1)真空泵、恒温干燥箱、真空干燥器。
(2)水解管。
(3)氨基酸自动分析仪。
4.试样处理
试样采集后用匀浆机打成匀浆(或者将试样尽量粉碎)于低温冰箱中冷冻保存,分析用时将其解冻后使用。
5.操作方法
(1)称样 准确称取一定量均匀的试样如乳粉,精确到0.0001g(使试样蛋白质含量在10~20mg范围内);均匀性差的试样如鲜肉等,为减少误差可适当增大称样量,测定前再稀释。将称好的试样放于水解管中。
(2)水解 在水解管内加6mol/L盐酸10~15mL(视试样蛋白质含量而定),含水量高的试样(如牛乳)可加入等体积的浓盐酸,加入新蒸馏的苯酚3~4滴,将水解管放入冷冻剂中,冷冻3~5min,再接到真空泵的抽气管上,抽真空(接近0Pa),然后冲入高纯氮气;再抽真空充氮气,重复三次后,在充氮气状态下封口或拧紧螺丝盖将已封口的水解管在(110±1)℃的恒温干燥箱内,水解22h后,取出冷却。
打开水解管,将水解液过滤后,用去离子水多次冲洗水解管,将水解液全部转移到50mL容量瓶内用去离子水定容。吸取滤液1mL于5mL容量瓶内,用真空干燥器在40~50℃干燥,残留物用1~2mL水溶解,再干燥,反复进行两次,最后蒸干,用1mL pH2.2的缓冲液溶解,供仪器测定用。
6.测定
准确吸取0.200mL混合氨基酸标准液,用pH2.2的缓冲液稀释到5mL,此标准稀释液浓度为5.00nmol/50μL,作为上机测定用的氨基酸标准,用氨基酸自动分析仪以外标法测定试样测定液的氨基酸含量。
7.结果计算
按下式计算:
式中 X——试样氨基酸含量,g/100g;
c——试样测定液中氨基酸含量,nmol/50μL;
F——试样稀释倍数;
V——水解后试样定容体积,mL;
M——氨基酸相对分子质量;
m——试样质量,g;
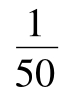 ——折算成每毫升试样测定的氨基酸含量,μmol/L;
——折算成每毫升试样测定的氨基酸含量,μmol/L;
109——将试样含量由纳克折算成克的系数。
十六种氨基酸相对分子质量:天冬氨酸133.1;苏氨酸119.1;丝氨酸105.1;谷氨酸147.1;脯氨酸115.1;甘氨酸75.1;丙氨酸89.1;缬氨酸117.2;甲硫氨酸149.2;异亮氨酸131.2;亮氨酸131.2;酪氨酸181.2;苯丙氨酸165.2;组氨酸155.2;赖氨酸146.2;精氨酸174.2。
计算结果表示为:试样氨基酸含量在1.00g/100g以下,保留两位有效数字;含量在1.00g/100g以上,保留三位有效数字。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




