不同的金属材料具有不同的性能,即使是同一种金属材料,在不同的结晶条件和热处理条件下也会具有不同的力学性能,这主要是因为其内部的晶体结构不同。
1.晶体结构的基本知识
固态物质按原子排列的特点可分为晶体和非晶体两类。
晶体是指原子按一定规律排列的固态物质,如图1-1所示。金刚石、石墨及绝大多数固态金属及其合金等均是晶体。晶体有固定熔点,各向异性。
非晶体是指原子呈不规则排列的固态物质,如普通玻璃、松香、塑料、沥青等。非晶体没有固定熔点,各向同性。
1)晶格
为了研究原子的排列规律,可以把晶体中的每个原子假想为近似静态的刚性小球。这样,晶体就可看成是由许多刚性小球按一定几何规则排列起来的。为了清楚地表明原子在空间排列的规律性,常将构成晶体的实际质点(原子、离子或分子)忽略,而将它们抽象为纯粹的几何点,称为阵点或结点。这些阵点可以是原子或分子的中心,也可以是彼此等同的原子群或分子群的中心,各个阵点的周围环境都相同。为了观察方便,做许多平行的直线将这些阵点连接起来,构成一个三维的空间格架,如图1-2所示,这种描述晶体中原子、离子或分子排列规律的空间格架称为空间点阵,简称为点阵或晶格。
2)晶胞
由于晶格中原子的排列具有周期性的特点,因而为了简便起见,可以从晶体中选取一个能够完全反映晶格特征的最小几何单元来分析晶体中原子的排列规律,这个最小的几何单元称为晶胞,如图1-3所示。实际上整个晶格就是由许多大小、形状相同的晶胞在空间重复堆积而成的。

图1-1 晶体中的原子排列

图1-2 晶格
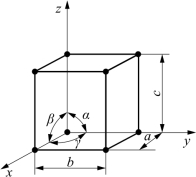
图1-3 晶胞
2.常见的金属品格类型
晶格描述了金属晶体内部原子的排列规律,金属晶体结构的主要差别就在于原子排列形式的不同。大多数金属元素具有简单的晶体结构,其中常见的有以下三种。
1)体心立方晶格
体心立方晶格的晶胞是一个立方体,在立方体的八个顶角和中心各排列一个原子,如图1-4所示。具有这类晶格形式的金属有α-Fe(912℃以下的纯铁)、钒、铬、钼、钨等。

图1-4 体心立方体晶格示意图
2)面心立方晶格(https://www.xing528.com)
面心立方晶格的晶胞也是一个立方体,在立方体的八个顶角和六个面的中心各有一个原子,如图1-5所示。具有这类晶格形式的金属有γ-Fe(912℃~1394℃的纯铁)、铝、镍、铜、金、银等。

图1-5 面心立方体晶格示意图
3)密排六方晶格
密排六方晶格的晶胞是一个六方柱体,在六方柱体的各个角上和上下底面中心各排列着一个原子,在顶面和底面间还有三个原子,如图1-6所示。具有这类晶格形式的金属有铍、镁、钛、锌等。
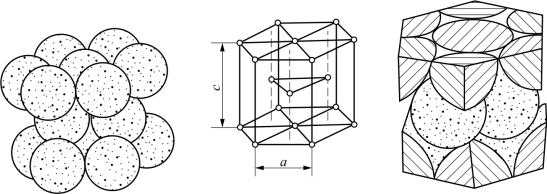
图1-6 密排六方晶格示意图
3.金属的实际晶体结构
晶体内部原子排列方向(称为晶格位向)完全一致,即由一个晶粒组成的晶体,称为单晶体。理想的金属单晶体在自然界几乎是不存在的,现在用人工的方法可以制造某些金属的单晶体,如单晶锗、单晶硅。单晶体在不同方向上的物理性能、化学性能和力学性能都不相同,即表现出各向异性。实际上金属是由许多外形不规则的晶粒组成的,即多晶体。由于多晶体中各个晶粒内部的晶格形式是相同的,只是晶格位向不同,因而各晶粒的各向异性互相抵消,使得多晶体在宏观上表现出各向同性。
4.合金的晶体结构
1)基本概念
(1)合金。合金是由两种或两种以上的金属(或金属与非金属)元素组成的具有金属特性的新物质。
(2)组元。组成合金的最基本的、独立的物质称为组元。
(3)合金系统。合金系统由给定组元按不同比例可配制出一系列成分不同的合金,这一系列合金构成一个合金系统,简称为合金系。
(4)相。相是指在纯金属或合金中,具有相同成分、相同结构并与其他部分有界面分开的均匀组成部分。
(5)组织。组织是指用金相观察方法看到的由形态、尺寸不同和分布方式不同的一种或多种相构成的总体。
2)合金的结构
合金之所以比纯金属性能优越,主要是因为其内部结构与纯金属不同。合金的内部结构比较复杂,但根据各元素在结晶时相互作用的不同可以分为以下三类。
(1)固溶体。在固态下两种或两种以上的物质互相溶解而形成的均匀相称为固溶体,如铜镍合金就是由铜(溶剂)和镍(溶质)形成的固溶体。固溶体具有与溶剂金属相同的晶体结构。
(2)金属化合物。合金各组元间相互作用而生成的具有金属特性的一种新相,称为金属化合物。金属化合物具有独特的晶体结构和性质,而与各组元的晶体结构和性质不同,一般可以用分子式来大致表示其组成。其性能特点是熔点高、硬度高、脆性大,如铁碳合金中的Fe3C。
(3)机械混合物
纯金属、固溶体、金属化合物是组成合金的基本相,由两相或多相按一定比例组成的物质称为机械混合物。机械混合物中各组成相仍保持各自的晶格与性能,机械混合物的性能介于各组成相性能之间,并由它们的大小、形状、分布及数量而定。工业上大多数合金属于机械混合物,如钢、生铁、铝合金等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




