1.氨的合成原理
![]()
氨合成是体积减小、可逆的放热反应,反应必须在高温高压并有催化剂存在的条件下才有较快的反应速率,且氨合成反应的热效应不仅与温度有关,还与压力、组成有关。
(1)化学平衡。由式(11-51)可得氨合成反应的平衡常数Kp表示为
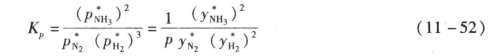
式中 p、 ——分别为总压和各组分平衡分压,MPa;
——分别为总压和各组分平衡分压,MPa;
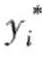 ——各组分平衡组分的摩尔分数。
——各组分平衡组分的摩尔分数。
加压时,平衡常数不仅与温度有关,而且与压力、气体组成也有关系。当压力在1.013~101.33MPa之间,化学平衡常数由下式进行计算:
![]()
式中 T——温度,K。
不同压力下β、I的值见表11-20所示。
表11-20 不同压力下β、I的值

不同温度、压力下,H2/N2=3(摩尔比)时氢氮混合气反应的Kp值见表11-21。
表11-21 不同温度、压力下氨合成反应的Kp值快

由此可见,温度一定时,平衡常数随压力的升高而增大;压力一定时,平衡常数随温度的升高而减小,故升高温度、降低压力有利于提高平衡氨含量。
另对加压时氨合成反应的影响因素还有气体的组成。通过计算,低的惰性气体含量和合适的氢氮比,有利于提高平衡氨含量。
(2)热效应。不同压力、温度下,纯氢氮混合气完全转化为氨的反应热效应为
![]()
![]()
式中 ΔHF——纯氢氮气完全转化为氨的反应热,kJ/kmol;
p——压力,MPa;(https://www.xing528.com)
T——温度,K。
工业生产中,反应物为H2、N2、NH3和惰性气体的混合物,由于高压下的气体为非理想气体,气体混合时吸热,故总反应热(ΔHR)为反应热(ΔHF)和混合热(ΔHM)之和,即
![]()
表11-22给出了氨浓度为17.6%系统ΔHF、ΔHM和ΔHR的值。当氨含量为yNH3时混合热可用内插法近似求解。即
![]()
式中 ![]() ——氨浓度为17.6%时的混合热,kJ/kmol。
——氨浓度为17.6%时的混合热,kJ/kmol。
表11-22 由纯氢氮合成含氨17.6%系统ΔHF、ΔHM和ΔHR的值
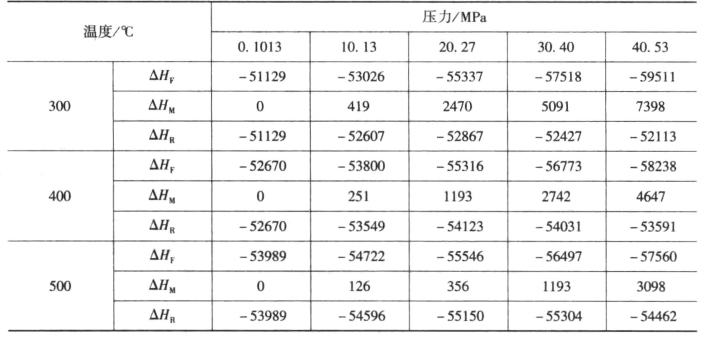
由表可见,氨合成反应的热效应随着反应压力和温度的升高而增大,实际生产中要注意热效应,防止催化剂烧结现象的发生。
(3)氨合成的催化剂。
①化学组成。能做氨合成催化剂的物质有很多,如铁、铂、钨、锰和钠等,但以铁为主体并添加促进剂的催化剂,因其具有价廉易得、在低温下活性良好、抗毒性能强,使用寿命长等特点而得到广泛推广。
未还原的铁系催化剂,活性组分为Fe3O4(符合FeO∶Fe2O3=1)。其中Al2O3、MgO是通过改善还原态铁的结构而呈现促进作用的(属结构型促进剂);K2O和CaO可使金属电子的逸出功降低,有利于氮的活性吸附,从而提高催化剂的活性(属电子型促进剂);CaO可以降低固体的熔点和黏度,有利于Al2O3和Fe3O4固熔体的形成;CaO的加入可使催化剂晶粒减小,比表面增大,以提高催化剂的低温活性;SiO2除具有“中和”等碱性组分的作用外,还可提高催化剂的抗水毒害和耐烧结性能。
②结构。通常制得的催化剂为黑色不规则颗粒,有金属光泽。堆密度随粒度增大而增大。催化剂还原后Fe3O4晶体被还原成细小的α-Fe晶体,疏松地处于Al2O3骨架上,其结构变成多孔海绵状,这些孔呈不规则树状,内表面积约为4~16m2/g。各国主要型号的氨合成催化剂的组成及性能见表11-23。
表11-23 各国主要型号的氨合成催化剂的组成及性能

(4)氨合成的动力学。
氨合成反应过程由气固相催化反应过程的外扩散、内扩散和化学反应动力学等一系列连续步骤组成。氨合成的的历程较为复杂,目前较为正确的解释是:N2、H2气相向催化剂表面靠近,其绝大部分自外表面向催化剂的毛细孔的内表面扩散,并在表面上进行活性吸附。吸附氮与吸附氢与气相氢进行化学反应依次生成NH、NH2、NH3,后者自表面脱附后进入气相空间,整个过程如下:
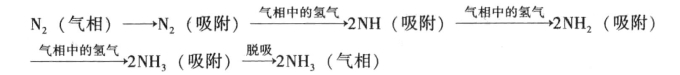
在上述反应过程中,当气流速度相当大及催化剂粒度足够小时,内、外扩散的影响均不明显,而在铁催化剂上吸附氮的速率在数值上又接近氨合成速率,即氮的活性吸附步骤进行得最慢,是决定反应速率的关键。这就说明整个催化反应的速率就可认为是化学反应动力学速率。
①影响化学反应速率因素。由化学反应速率的影响因素可知:温度和组成一定时,增加压力使总反应速度加快;压力一定时,温度升高,其反应速率增大。
②扩散对反应速度的影响。
图11-27为催化剂颗粒度在一定温度下对氨合成反应的影响。由图可知:通常情况下,温度越高,内表面积利用率越小;氨含量越大,内表面利用率越大;随催化剂粒度的增加,内表面利用率大幅度下降。采用小颗粒催化剂可提高内表面利用率。但颗粒过小,单位容积填充质量降低,且易发生催化剂中毒失活。
由上述氨合成动力学分析可知,要使氨合成反应速率高,必须控制较高反应温度、高的反应压力和颗粒小的催化剂。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




