(一)焙烧反应
焙烧硫铁矿的反应,主要是矿石中的FeS2与空气中的氧反应,生成二氧化硫炉气。焙烧反应分两步进行。
1.FeS2受热分解为FeS和硫黄
![]()
由于反应是吸热反应,理论上温度越高,对反应越有利。另外,硫黄平衡蒸气压的变化也表明了这一点(见表10-1)。
表10-1 硫黄平衡蒸气压与温度的关系

硫铁矿释放出硫黄后,形成多孔形的FeS。
2.生成的FeS和硫黄与氧反应

硫铁矿焙烧总反应式:

矿石的种类、粒度以及矿石中易燃物的含量等因素,都会影响硫铁矿焙烧时的着火点。通常为了保证硫铁矿焙烧完全,工业上控制焙烧温度在600℃以上。
(二)焙烧反应动力学
硫铁矿的焙烧是非均相反应过程。反应在两相的接触表面上进行,反应过程可看成由以下步骤组成。
(1)FeS2分解。
(2)氧向硫铁矿表面扩散。
(3)氧与FeS反应。(https://www.xing528.com)
(4)生成的二氧化硫由表面向气流主体扩散。此外,在表面上还存在着硫黄蒸气向外扩散及氧和硫的反应等。
焙烧反应的过程速率与过程的扩散阻力及化学反应速率有关。
由前面的分析可知,硫铁矿的焙烧反应,可分为FeS2分解和FeS及单质硫氧化两步。FeS的氧化反应在矿料颗粒外表面及整个颗粒内部进行。矿粒外表面FeS与氧反应后,生成了氧化铁,当氧与颗粒内部的FeS继续反应时,必须通过颗粒表面的氧化铁层。而内部生成的二氧化硫,也必须通过氧化铁层扩散出来。氧化铁层随着焙烧反应的进行逐渐变厚,氧和二氧化硫通过的扩散阻力也逐渐增大。
确定焙烧过程究竟是动力学控制,还是扩散控制,要通过实验完成,即考察操作温度、反应时间及颗粒大小等因素对过程的影响。
1.反应速率
FeS2和FeS在空气中的氧化速率及FeS2在氮气中的分解速率的变化情况可参考脱硫速率的舟皿试验结果,如图10-1所示。由图可知,FeS2的分解速率大于FeS的氧化速率,FeS氧化反应慢,是整个反应过程的控制步骤。
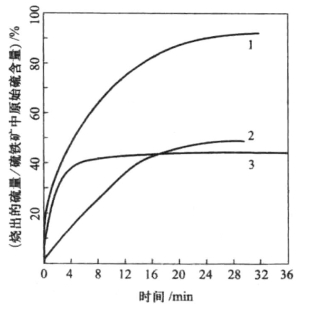
图10-1 脱硫速率的舟皿试验结果
1—FeS2在空气中燃烧;2—FeS在空气中燃烧;3—FeS2在氮气中加热
2.温度
FeS2的分解反应活化能约为126kJ/mol,图10-2为硫铁矿的分解速率与温度的关系,显示了FeS2的分解速率随温度的升高而加快,而且在较高温度下有较大提高,属于动力学控制。FeS氧化反应活化能为13kJ/mol,反应速率随温度的增加不显著,因此属于扩散控制。图10-3为FeS燃烧速率与温度的关系。要提高FeS的氧化速率,需要减小扩散阻力,增加气固相际接触面积,减小矿石粒度。

图10-2 硫铁矿的分解速率与温度的关系
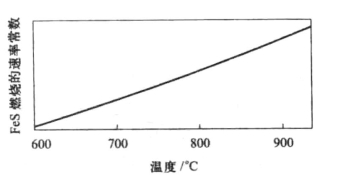
图10-3 FeS燃烧速率与温度的关系
随着温度的升高,化学反应速率加快的程度远远超过扩散速率的增长,因此在高温时,硫铁矿焙烧会转为扩散控制。提高氧的浓度会加快焙烧过程的总速率,氧是影响扩散速率的主要因素,但由于用富氧空气焙烧硫铁矿不经济,所以通常只用空气焙烧。
综上所述,要提高硫铁矿的焙烧速率,应从以下几方面考虑:提高反应温度;减小矿石粒度;提高入炉空气中的氧含量;增强气固两相间的相互运动等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




