(一)辣椒种质资源的收集
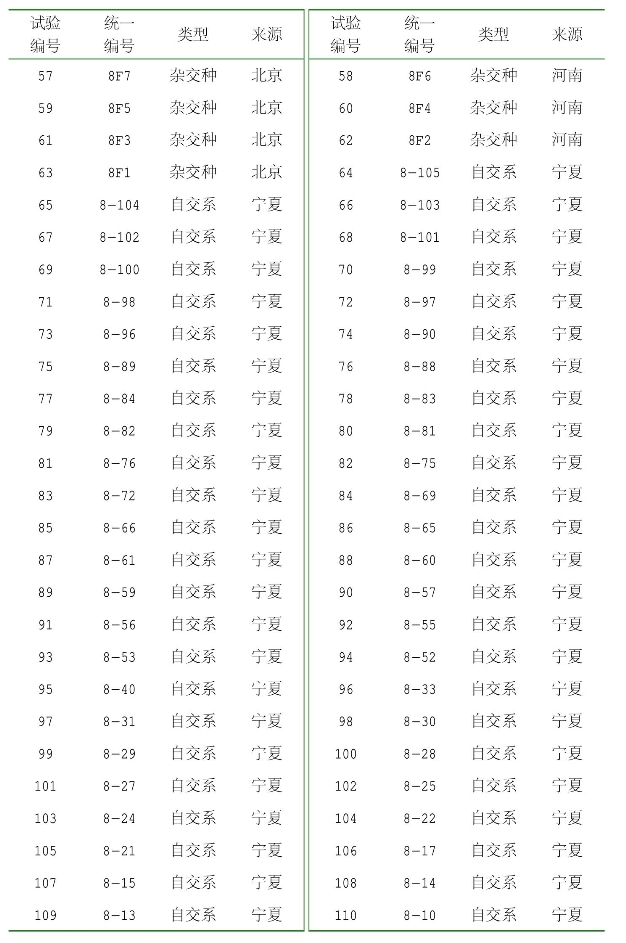
辣椒(Capsicum spp.)属于茄科一年生或多年生作物,最早起源于中南美洲热带地区,引进中国后,分布广泛。按照植物学分类,辣椒被划分为5个主要的栽培种,分别为C.annuum、C.frutescens、C.chinense、C.baccatum和C.pubescens。我国的辣椒品种主要属于C.annuum。我国的辣椒种质资源主要以一年生辣椒(Capsicum annuum L.)为主,是我国第二大蔬菜作物,现栽培面积213.3万hm2左右,仅次于结球白菜。辣椒也是宁夏栽培的主要蔬菜品种,栽培面积占整个蔬菜栽培面积的20%左右,居第二位。宁夏具有优良的辣椒品种资源,经过长期的自然选择和人工选择,形成了以银川羊角椒为代表的优质地方品种,但在20世纪90年代末期,由于外来商业品种的大面积推广,致使宁夏一些品质优良的地方辣椒品种的种植面积逐年减小,甚至受到逐步丧失的潜在威胁。另外,由于传统的育种方式往往没有考虑组合配置遗传组成的差异,大量使用同一亲本,导致育成品种间的遗传基础日趋狭窄,辣椒育种者同样面临亲本遗传基础狭窄的困境,亟须加强辣椒种质资源的引进及对其农艺性状的了解。因此,宁夏农林科学院种质资源研究所2015—2019年收集辣椒品种(系)204份(表2-1)。
表2-1 供试材料

(续表)
(续表)

(续表)

(二)辣椒种质资源的鉴定
目前,国内外已有许多关于辣椒种质资源遗传多样性的相关报道。邹学校等以抗病性、果实营养成分含量和农艺性状等15个性状为主成分值,对36个地方品种进行了遗传差异评价;张璐等通过28个RAPD引物对辣椒30个栽培品种进行PCR扩增,结果表明辣椒品种间的遗传相似性与辣椒果味或果形之间总体上无相关性;王玲等利用RAPD标记对从国内外收集的一年生辣椒自交系和杂交组合的遗传多样性进行了研究,14个随机引物在22份参试材料中共扩增出1258个条带,其中多态条带比率接近50%,表明供试辣椒之间的遗传基础较窄,DNA分子水平上辣椒亲缘关系与传统方法研究结论基本一致;Nicolai等结合植物学性状,利用28个SSR标记对89个国家的1352份辣椒材料进行了遗传多样性分析,发现亚群间在植物学性状间存在明显的差异;雷刚等基于辣椒的28个性状的表型数据,根据果形指数大小将603份辣椒材料分成5组,并根据所获得的优化方案最终在表型水平建立了包含91份种质的辣椒核心种质;赫卫等对来自全国各地的辣椒育种材料进行了鉴定分析,结果表明,依据果形、单株果数、熟期和果色,205份种质分成7类,辣椒形态学性状间存在较高相关性,单株果数、叶形、株型、果形、茎绒毛、花梗着生状态、熟性、花柱色是最关键的性状。这些研究证明,辣椒遗传多样性分析对于辣椒育种材料的遗传基础研究具有重要的作用。基于前人的研究结果,宁夏农林科学院种质资源研究所蔬菜课题组对引进的204份辣椒品种(系)的27个表型性状进行了的调查研究(表2-2、表2-3),明确了这些辣椒品种(系)资源的遗传特性和亲缘关系。
表2-2 辣椒数量性状调查的项目及标准

(续表)

表2-3 辣椒质量性状赋值情况

1.表型性状的基本统计分析
基于27个辣椒的表观性状,204份辣椒品种(系)的平均变异系数为23.94%(表2-4),说明宁夏辣椒种质资源的形态学特征存在比较广泛的变异,遗传多样性比较丰富。每个性状的变异系数越大,与其相对应的性状变异程度也就越大。17个数量性状中,“中心柱长”变异系数最大,为52.40%,可能的原因是数量性状受多基因控制;“叶形指数”变异系数最小,为9.27%,平均变异系数为26.91%。10个质量性状中,“果形”的变异系数最大,为46.09%,平均变异系数为18.89%。但同时也要注意,对于质量性状而言,由于其统计量是通过赋值后进行数据统计的,赋值的差异会对变异系数的大小产生影响。
表2-4 不同表型性状变异分析
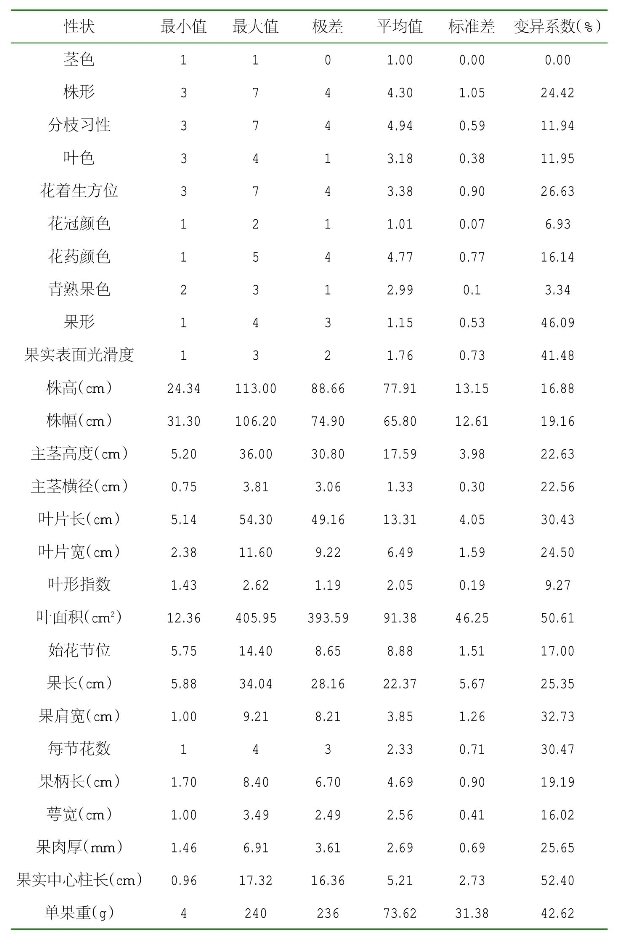
宁夏辣椒种质资源植物学性状的Shannon信息指数(H′)表明所分析数值的丰富度及均匀度,是反映种质间变异的重要指标,指数越高,说明表型性状变异越丰富。从结果看,204份辣椒种质资源的17个数量性状的平均Shannon信息指数高于10个质量性状的平均Shannon信息指数,介于1.3~3.5;17个数量性状中,“每节花数”多样性信息指数最大,为3.474 5,“萼宽”多样性信息指数最小,为1.336 2(表2-5)。表型性状的Shannon信息指数分析显示,27个植物学性状的平均多样性信息指数为1.696 7(表2-5),说明宁夏农林科学院引选的204份辣椒种质资源表型变异较丰富,具有较高的变异性和多样性,在辣椒遗传育种工作中有较好的利用价值。
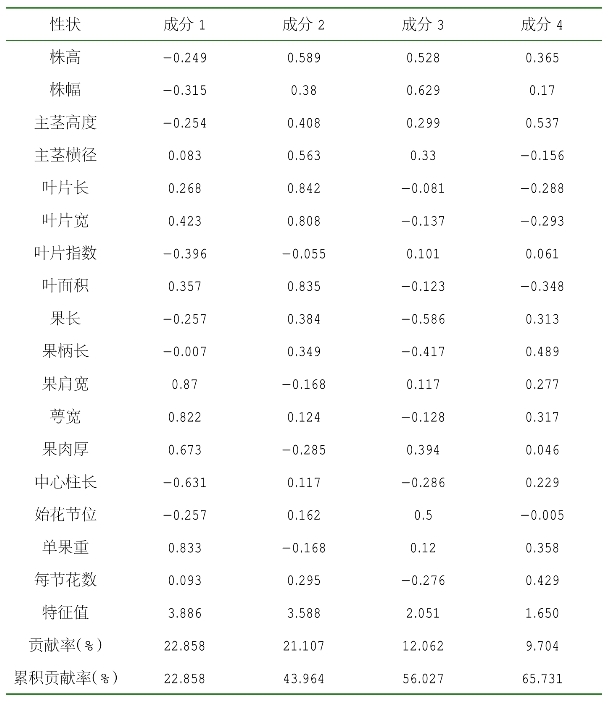
2.数量性状的主成分分析
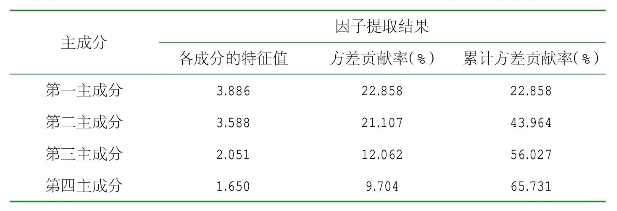
主成分分析,指根据各指标间的相互关系,利用降维的思想把多个指标转换成较少的几个互不相关的综合指标,从而使进一步研究变简单的一种统计方法。主成分分析结果显示,前4个主成分其特征值分别为3.886、3.588、2.051、1.650,其方差贡献率分别为22.858%、21.107%、12.062%、9.704%,积累方差贡献率为65.731%(表2-6)。主成分1反映的是果肩宽、萼宽、果肉厚等果实的数量形态特征,主成分2反映的是叶片长、叶片宽、叶面积等叶片的数量形态特征,主成分3、4反映的是株高、株幅、主茎高度等植株长势的数量形态特征。这4个主成分分别可以概括为果形因子、叶形因子、株形因子,这些性状可以作为评价辣椒种质资源的主要指标(表2-7)。
表2-5 宁夏辣椒种质资源表型性状的多样性比较
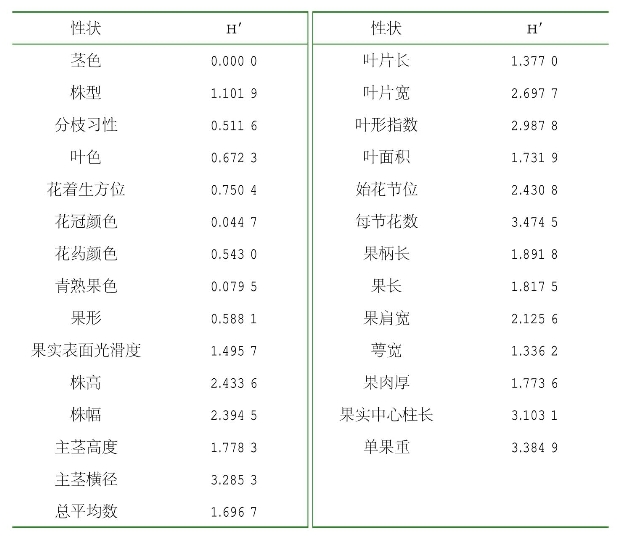
表2-6 前4个主成分的特征值和贡献率
3.表型性状的聚类分析
基于27个形态性状,204份辣椒种质材料被聚为了六大类(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ)(图2-1)。
第Ⅰ类包括7F1、7F2、7F4、7F5、7F6、7F8、7F9、7F10、7F11、7F12、7F13、7F14、7F15、7F16、7F17、7F18、7F19、7F20、7F21、7F22、7F23、7F24、7F25、7F26、7F27、7F28、7F29、7F31、7F32、7F33、7F34、7F35、7F37、7F38、7F39、7F41、8F1、8F5、8F13、8F14、8F42、8F43、8F45、8F49、8F51、8F52、8F53、8F57、8F58、71701、71702、71703、71704、71705、71706、71707、71708、71709、71710、71711、71712、71713、71714、71715、71716、71718、71719、71720、71721、71722、7B24、7B25、7B26、7B27、7XW、K1、K2、K3、K4、K5、K6、K7、K9、K10、K11、K12、K13、K14、K15、K16、K17、K18、K19、K21、K22、K23、K24、K25、K26、K27、K28、K29、K30、K31、761号、774号、73-9、73-10、8-5、8-17、8-21、8-22、8-25、8-31、8-33、8-40、8-52、8-60、8-61、8-66、8-69、8-89、8-96、8-97、8-100、8-102、8-104、8-105、8-JQ1540、8-JQ1541、8-JQ1542、8-JL5、8-JL6。这133份材料,分枝中等或多,叶片为绿色或深绿色,花冠、花柱颜色均为白色,花药为紫色或蓝灰色,果形为长果形,果肩较窄,青熟果为绿色,果实表面微皱或皱。
表2-7 辣椒17个数量性状的主成分分析
第Ⅱ类包括8-JL9,共1份材料,分枝中等,叶色为深绿色,花冠为白色,花药为黄色,牛角椒,果实大小适中,青熟果为黄色,果实表面光滑。
第Ⅲ类包括8-57、8-59、8-81、8-83、8-84、8-88、8-101,这7份材料植株分枝能力中等或多,叶色为绿色,花冠、花柱颜色均为白色,花药为紫色,果实为长果形,均为牛角椒,青熟果色均为绿色,果实表面光滑或微皱。
第Ⅳ类包括7F36、7F40、8-1、8-2、8-3、8-5、8-6、8-7、8-9、8-10、8-11、8-13、8-14、8-24、8-27、8-28、8-29、8-30、8-53、8-55、8-65、8-72、8-75、8-76、8-82、8-90、8-99、8-103、7F3、8F2、8F3、8F4、8F5、8F6、8F7、8F8、8F9、8F10、8F11、8F12、8F15、8F16、8F17、8F18、8F19、8F20、8F44、8F46、8F47、8F48、BY、8-JL7、8-JL10、8-LD-11、8-37-94、8-LM-9、8HM105、8-TS2、8-RK-01、8-RK-02、8-RK-03,这61份材料植株分枝能力中等或多,叶色为绿色,花冠、花柱颜色均为白色,果形为长果形,果肩较宽,果实较长,单果重较大,青熟果色均为绿色,果实表面光滑或微皱。
第Ⅴ类包括8-98,共1份材料,植株分枝能力中等,叶色为绿色,花冠为紫色,花药为蓝灰色,果形为圆锥形,为水果型辣椒,果实较小,青熟果为绿色,果实表面光滑。
第Ⅵ类包括8-56,共1份材料,植株分枝能力中等,叶色为绿色,花冠为浅黄色,花药为紫色,果形为长果形,果实大小适中,青熟果为绿色,果实表面光滑。
亲本材料是进行辣椒育种工作的前提基础,但遗传基础狭窄导致难以培育出突破性品种。因此,分析亲本材料的遗传多样性,比较材料相互间亲缘关系的远近,对于辣椒的育种工作具有重要的指导意义,为针对辣椒果实性状的新品种选育提供了参考数据和亲本资源。这些种质材料聚类分析的结果,可以使辣椒杂交育种有目的地进行种质资源的优化组合,并采用最佳方案,以期选育出优质、高产的辣椒品种。但同时也应考虑到,虽然产量、品质是育种的主要目标,但随着目前育种方向的多元化,仍需依据宁夏的气候因素和市场特征加大地方品种资源的收集及从国内外引种的方向和力度。另外,形态学标记研究虽然是检测遗传变异最传统、最直观的方法,但是也要考虑到表型性状易受基因上位效应及环境因素的影响,若要更准确地揭示辣椒资源的遗传多样性,还需与分子标记技术相结合,获得更全面的辣椒种质资源亲缘关系及客观评价。
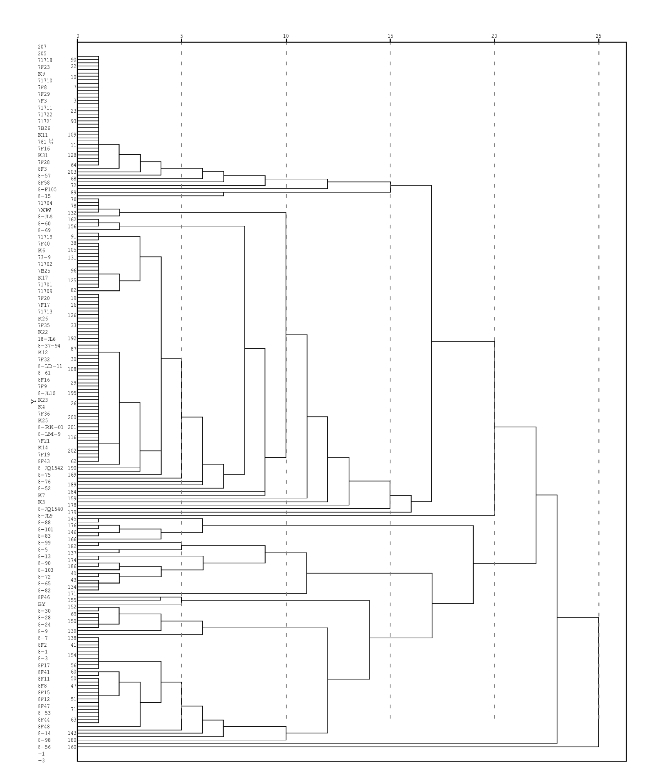
图2-1 204份材料基于27个形态性状的聚类图
(二)基于SSR标记的遗传多样性分析
SSR(Simple Sequence Repeats),即微卫星标记,也称STMS(Sequence Tagged Micro-satellite)和SSRP(Simple Sequence Repeat Polymorphism),又称短串联重复多态性(Short Tandem Repeat Polymorphism,简称STRP)。SSR是由Moore和Sollotterer等于1991年提出。它的重复单位是由含1~6个碱基序列串联重复而成的DNA序列,由于重复序列数目不同或重复程度不完全而形成每个座位的多态性,如(CA)n、(GAG)n、(GACA)n、(GCC)n。微卫星DNA两端有一段保守的单拷贝序列,通过此可设计一段互补序列的引物,并对SSR进行PCR扩增,从而可检测出SSR核心序列的长度多态性。由于SSR多态性是由简单序列重复次数的差异引起的,由于该特性的存在可通过高浓度的琼脂糖或聚丙烯酰胺凝胶电泳进行检测,最终扩增的DNA带上会出现小片段或一些不连续的条带。由于SSR可在多个等位基因间显示差异,因此SSR标记这一技术一经问世,便很快在动、植物的遗传图谱构建、品种鉴定、QTL分析、亲缘关系鉴定、DNA指纹图谱构建及分子辅助育种中广泛应用,同时该技术还应用于人类基因组研究中,并且已构建了1张由5 264个标记组成的微卫星图谱。SSR标记检测速度快,所需DNA量少,信息量大;标记呈共显性,可鉴别杂合子和纯合子;一般检测到的是一个单一的多等位基因位点。
1.SSR标记的筛选
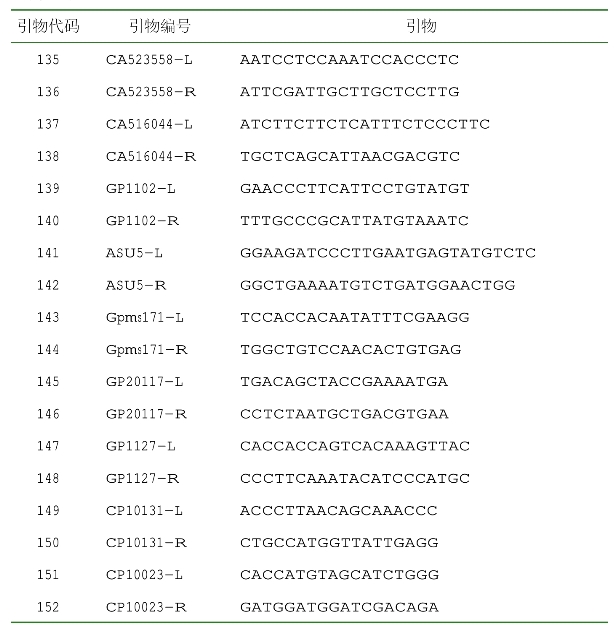
宁夏农林科学院种质资源研究所基于76对SSR特异性引物(表2-8),对204份辣椒种质资源(表2-1)进行了研究。
表2-8 SSR引物序列信息

(续表)

(续表)

(续表)

(续表)

(续表)
 (https://www.xing528.com)
(https://www.xing528.com)
结果有21对标记在204份材料间表现出多态性且扩增效果较好,多态性标记的比例为27.6%。用上述21对SSR标记进行扩增,共检测到254个多态性位点,平均每对引物检测到12.01个多态性位点,引物扩增部分结果见图2-2、图2-3、图2-4。对204份材料进行多态性分析,多态性较好,可用于遗传多样性分析的引物见表2-9。
2.SSR扩增后辣椒种质亲缘关系的分析和聚类
利用NTSYS-pc分析软件,对SSR扩增产物转化后的1,0数据,计算204份材料间的遗传相似系数,并用UPGMA进行聚类分析。可将204个供试品种按亲缘关系远近共分为VI类(图2-5)。供试品种间的遗传相似系数介于0.169~0.510。
表2-9 筛选出的SSR引物序列信息

(续表)

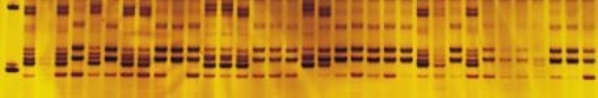
图2-2 引物BM59622所扩增部分材料的电泳结果
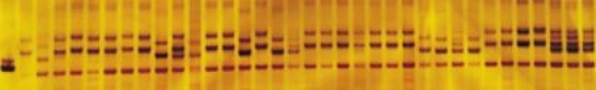
图2-3 引物GP20036所扩增部分材料的电泳结果

图2-4 引物Epms-310所扩增部分材料的电泳结果
由图可见,材料K30、K22、K19、K4、K13、K7、K3、K5、K2、K1、K31、K29、K9、K26、K24、K23、8F58、K28、K27、K18、K15、K17、K14、K11、K25、K21、K10、K6、K16、K12、8F57、8F53、8F52、8F49、8F51、8-98、8-84、8-56、8-52、8-33、8-55、8-53、8-97、8-81、8-96、8-76、8-75、8-65、8-72、8-69、8-61、8-66、8-90、8-57、8-60、8-59、8-89、8-83、8-82、8-40、8-31、8-30、8-29、8-28、8-27、8-25、8-24、8-21、8-88、8-22、8F48、8F46、8F45、8F42、8F41、8F8、8F20、8F18、8F15、8F14、8F44、8F43、8F17、8F16、8F19、8F10、8F11、8F9、8F7、8F6、8F5、8F4、8F3、8F2、8F1、8-100、8-101、8-99、8F13、8F12、8F47、8-105、8-104、8-103、8-102、7F26、7F25、7F24、7F12、7F11、7F23、7F16、7F14、7F13、7F10、7F22、7F21、7F19、7F18、1716、1715、1713、1712、1711、1714、7F20、7F17、1710、1721、1722、1709、7F15、1705、1719、1718、1720、1706、1708、1707、1704、1703、761号、8-JQ1541、8-JQ1540、8-JL5、8-JL9、8-JL10、8-JL6、1702、8-37-94、1701、8-JQ1542、8-RK-01、8-JL7、8-LD-11、8-RK-03、8-RK-02、8-LM-9、8-TS2、8HM105、774号、B27、B26、B24、BY、XW、73-10、73-9、B25、8-14、8-13、8-9、8-3和8-6共174份材料被聚合为第Ⅰ类;
8-2、8-11和7F9共3份材料被聚为第Ⅱ类;
7F40和F36共2份材料被聚为第Ⅲ类;
7F37、7F35、7F33、7F34、7F32、7F31、7F29、7F28和7F27共9份材料被聚为第Ⅳ类;
8-17、8-5、7F8、7F38、7F6、7F5、7F4、7F2、7F1、7F41和7F39共11份材料被聚为第Ⅴ类;
8-15、8-7、8-1和8-10共4份材料被聚为第Ⅵ类。
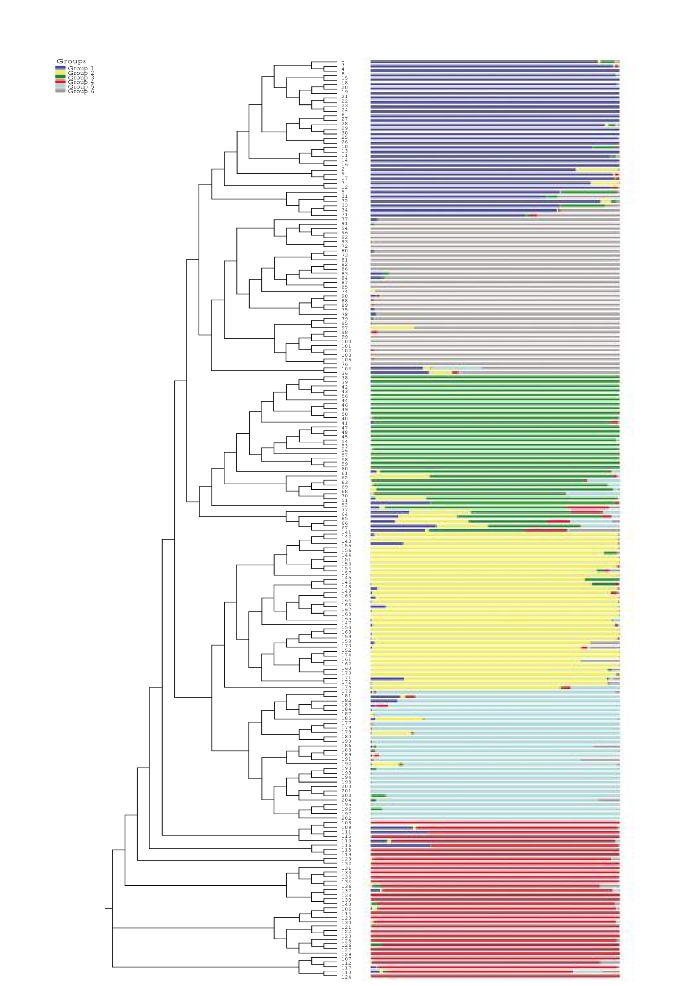
图2-5 204份辣椒资源亲缘关系树状图
从结果看,表型聚类和分子标记聚类的结果大致是相同的,但也有个别的品种存在分别不一致的现象;其主要的原因是表型性状受环境影响较大,在一定程度存在可变性。另外,本研究只是选择了部分特异的表型性状和部分特异性的分子标记,无法覆盖和反应每次材料完整的表型和完整的基因组,所以造成表型聚类与分子标记聚类之间存在一定的差异。
植物新品种的产生是人工选择和自然选择双重作用的结果,既反映人们的主观意愿和能力,又反映其在栽培条件下发生遗传变异的客观规律。因此,在进行品种分类研究时,既要将植物的自然演化规律考虑进来,又要将人类在其中所起的作用考虑进来。由于作物遗传背景的复杂性,基因组的杂合度高,形态学性状和生理代谢易受环境影响,这就给种质的鉴定、评价和利用带来了较大的阻力。植物种质在DNA分子水平上的差异结果表明,其亲缘关系较近的辣椒品种在SSR带型上具有较好的一致性。这种较好的特性适合于辣椒品种的筛选、鉴定与评价,为我们以后的品种选育工作提供了很好的判断依据。
(三)基于表型数据及SSR分子标记数据的核心种质构建
1.基于表型数据的核心种质构建
对宁夏农林科学院种质资源研究所提供的204份辣椒种质资源(表2-1),参照李锡香等《辣椒种质资源描述规范和数据标准》对辣椒的农艺性状进行描述并赋值,设定10个取样比例(10%、20%、30%、40%、50%、60%、70%、80%和90%),参考采用最小距离逐步聚类法,以欧式距离为遗传距离,结合类平均法、离差平方和法、最长距离法和最短距离法4种系统聚类方法进行聚类分析。试验采取了3种取样方法对样品进行抽取,对聚类图的最小遗传距离水平各组遗传材料分别按照以下3种方法进行取样:随机取样法,随机从每组中选取一个样品进入下一轮聚类;偏离度取样法,从每组中选取具有较大偏离度的样品进入下一轮聚类;优先取样法,从每组中选取具有极大或极小性状表型值的样品进入下一轮聚类。
采用连续性性状的均值差异百分率、方差差异百分率、极值符合率、变异系数变化率比较不同的新种质。均值比较采用Newman-Student-Keuls检验进行,方差同质性检验采用Levene’s测验进行。差异显著性分析采用SPSS 11.0软件Compare means程序的Independent-Samples T-Test命令进行。以上指标中,均值差异百分率越小,方差差异百分率、极差符合率和变异系数变化率越大,说明核心种质的代表性越好。
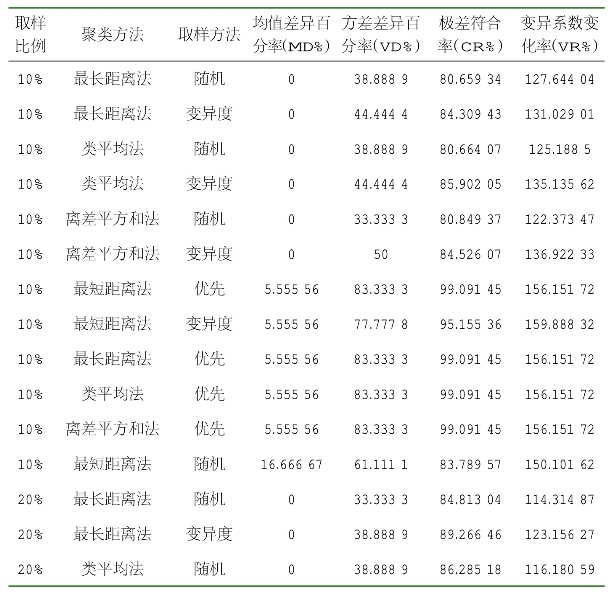
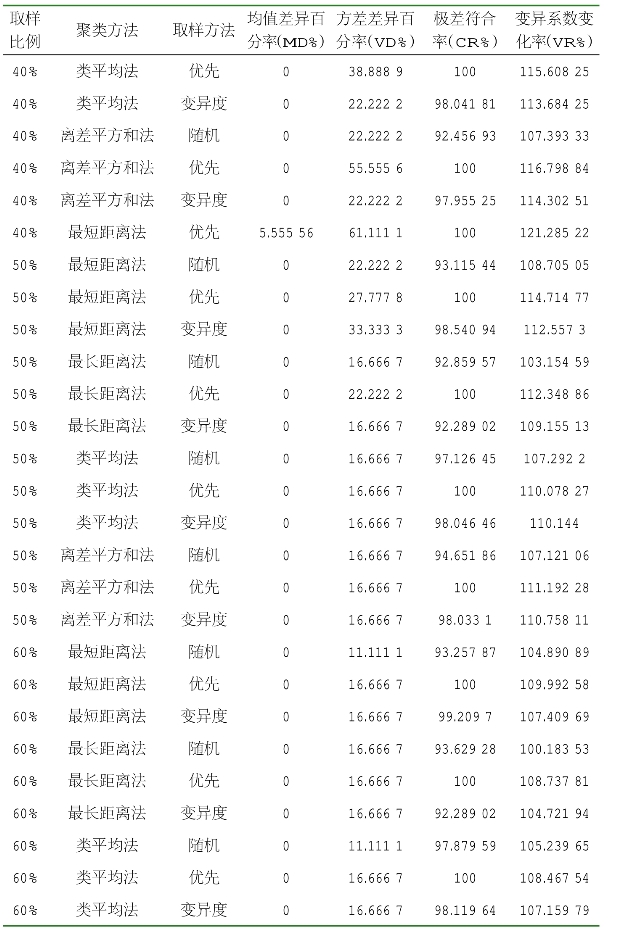
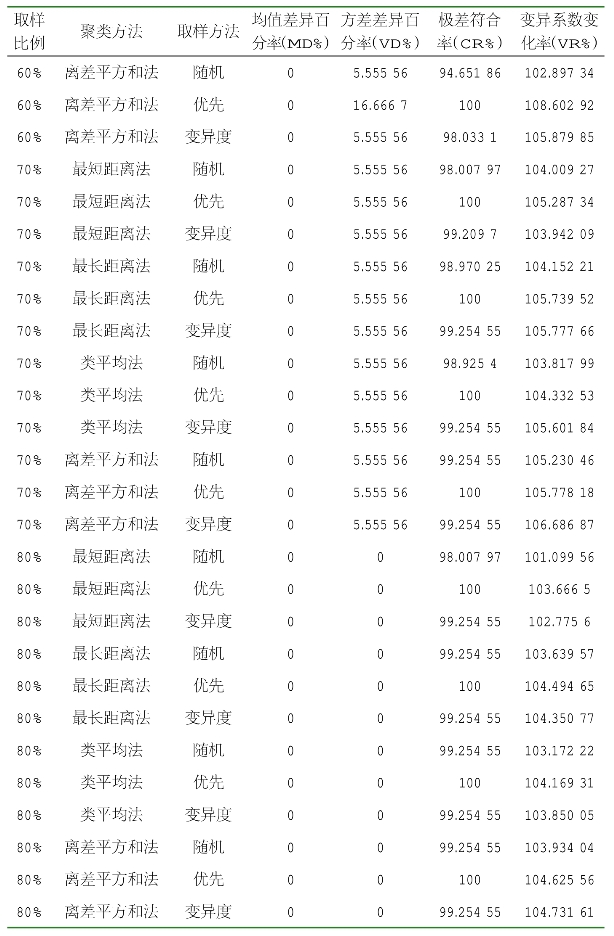
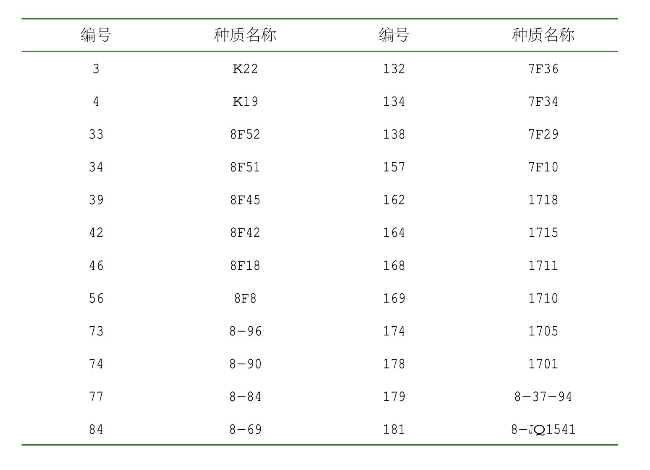
由表2-10可知,当取样比例为20%、采用离差平方和法聚类、优先取样法时获得的核心种质,其均值差异百分率最小,为0,方差差异百分率最大,为72.222 22%,极差符合率最大,为100%,变异系数变化率较大。当取样比例为20%,采用离差平方和法聚类、优先取样法时获得的核心种质名单见表2-11。
表2-10 基于表型的核心种质评价
(续表)
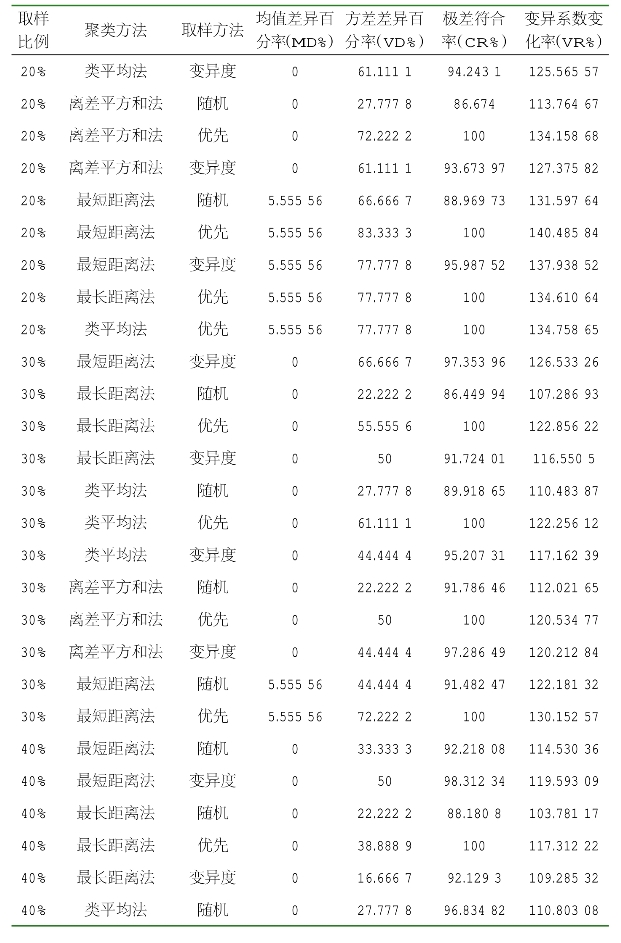
(续表)
(续表)
(续表)
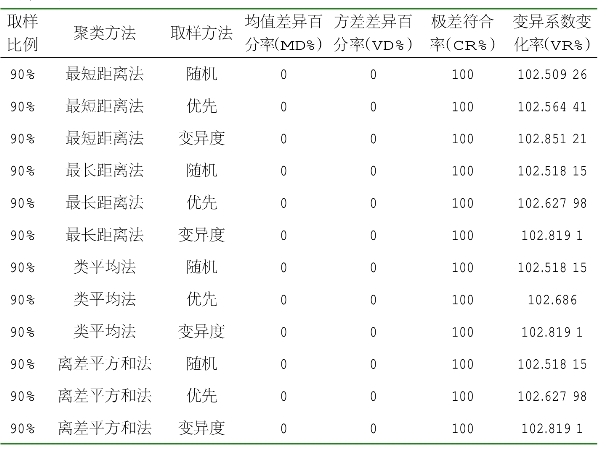
表2-11 基于表型的核心种质名单
(续表)
2.基于SSR分子标记数据的核心种质构建
采用改良CTAB法提取辣椒基因组DNA,SSR引物以及扩增程序同上。SSR数据统计,有带记为“1”,无带记为“0”,形成0-1矩阵进行数据分析。设定10个取样比例(10%、20%、30%、40%、50%、60%、70%、80%和90%),参考采用最小距离逐步聚类法,以欧式距离为遗传距离,结合类平均法、离差平方和法、最长距离法和最短距离法4种系统聚类方法进行聚类分析。试验采取了3种取样方法对样品进行抽取,对聚类图的最小遗传距离水平各组遗传材料分别按照以下3种方法进行取样:随机取样法,随机从每组中选取一个样品进入下一轮聚类;偏离度取样法,从每组中选取具有较大偏离度的样品进入下一轮聚类;优先取样法,从每组中选取具有极大或极小性状表型值的样品进入下一轮聚类。
用MS-Excel 2003计算并比较核心种质多态性位点百分率、Shannon多样性指数以及Nei's基因多样性指数。
204份辣椒种质的Shannon多样性指数为0.562,取样比例为90%、80%、70%、60%和50%,与204份种质的多样性指数相比差异不显著。因此,基于SSR分子标记的核心种质为取样比例为50%时是比较合理的。
表2-12 基于SSR分子标记的核心种质评价

(续表)

注:核心种质第一个数字表示取样方法,1=优先取样+多次聚类随机取样,2=优先取样+多次聚类变异度取样;第二个数字表示遗传距离类型,1=Simple matching,2=Jaccard,3=Nei and Li;第三个数字表示系统聚类方法,1=Single linkage,2=complete linkage,3=Median,4=centroid,5=UPGMA,6=WPGMA,7=Flexible-beta,8=Ward’s。*表示在P=0.05水平与204份种质相比差异不显著
表2-13 基于SSR分子标记的核心种质名单

3.辣椒核心种质最终构建结果
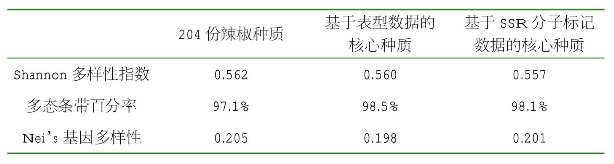
比较2个核心种质名单,发现基于SSR分子标记数据的核心种质有50份,其中包含了基于表型数据的核心种质40份。2个核心种质的比较见表2-14。比较发现,基于表型数据的核心种质的评价参数与基于SSR分子标记数据的核心种质相比差异不显著,与204份辣椒种质相比差异不显著。因此,基于表型数据的40份核心种质可作为最终的辣椒核心种质。
表2-14 两个核心种质的比较
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




