医药圈子里流传一个段子:“一颗药的成本只要5美分,但为什么要卖500美元?因为那是第二颗,第一颗的成本是50亿美元。”言下之意,药价之昂贵,在于其巨大的研发成本[10]。研发一种新药,本身需要的时间就在10年以上,研发的成本平均大概在25亿美元之上,并且风险很高[11]。
伊马替尼(格列卫),从发现靶点到获批上市,耗费了约50年,制药企业Novartis的投资超过50亿美元,成就了数位美国科学院院士,还催生了不少医学上的重大发现[12]。
这些全球巨头医药公司的研发就是“烧钱”。一款新药平均要砸几十亿美元的开发经费。所以,新药上市了,不但要赚药物开发的钱,还要赚过去失败项目烧掉的经费,更要为下一个药物开发预留经费。定价高可想而知。如果定价连成本都覆盖不了,任何一直做亏本生意的药企肯定会倒闭。
在电影《我不是药神》热播后关于药品价格高企原因的报道铺天盖地,无论是在网上还是平面或电视媒体上原因似乎都指向了药品高昂的研发成本和巨大的研发风险。再看下面两个表格,表8-2和表8-3似乎可以得出高研发投入与高药品价格具有极强的相关性。
表8-2 全球研发投入前十药企2015和2016年研发投入与销售收入对比

续表
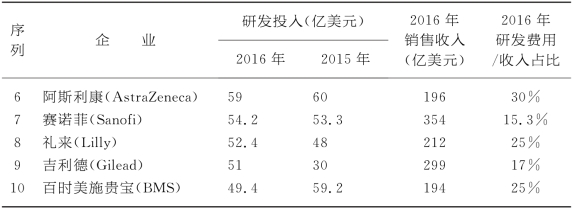
表8-3 部分欧美原研药品进入中国市场的价格

那么药品的研发成本到底有多高呢?欧美药品开发商提供的研发费用是真实的吗?可以被质疑吗?药品的价格究竟又是如何确定下来的呢?下面通过梳理格列卫的研发过程来揭开所谓50年研发时间和50亿美元研发成本的秘密,进而揭开欧美药企药品定价的神秘面纱。
1956年,Peter Nowell从海军退役,回到了故乡费城。在那里,他加入了宾夕法尼亚大学病理系,主攻白血病和淋巴瘤的研究。
1959年,Peter Nowell发现“费城染色体”,这项研究于1960年在Science上发表,整个癌症研究领域为之震动!费城染色体的发现是白血病研究领域的一个重要突破。
1973年,芝加哥大学的Janet Rowley教授在彼得的发现基础上,发现费城染色体之所以短,是因为发生了染色体的易位——人类的9号染色体与22号染色体发生了一部分的交换,让22号染色体短了一截。
1983年,美国国立癌症研究所(NCI)与Erasmus大学的学者们发现,9号染色体上的Abl基因,恰好与22号染色体上的BCR基因连到了一起,产生了一条BCR-Abl融合基因。这条融合基因编码了一种奇特的酪氨酸激酶。它不受其他分子的控制,一直处于活跃状态,导致不受控的细胞分裂,引起癌症。当研究人员们将融合基因导入小鼠的体内后,小鼠果然出现了致命的白血病症状。这个发现最终证实,BCR与Abl两条基因的融合,是此类白血病的根本原因[13]。
从1956年Peter Nowell加入了宾夕法尼亚大学病理系到1973年芝加哥大学的Janet Rowley教授发现费城染色体短的原因,再到1983年NCI与Erasmus大学的学者们发现此类白血病的根本原因,时间经过了28年,研究工作主要在4个研究机构即宾夕法尼亚大学、芝加哥大学、NCI、Erasmus大学展开。这28年的研究主要是基础医学和生物学、病理学的研究,其研究经费主要来自于国家拨款、私人和私营企业及各种基金会对大学的捐款,用于科研和教学,主要是培养年轻人才,这是国家和社会对基础学科的投入,也是对医学教育的投入,推动的是整个医药学的进步和国民教育水平。这与某个制药公司的单一产品的成本有关系吗?再说这28年基础研究的成本或者这几个研究者得到的研究经费到底有多少呢?确切的数字笔者并没有查询到,但在中国真正的科研工作者心里应该是有数的。因此这28年的时间和发生的费用是不能算作格列卫的研发时间和研发费用成本的,更不能列入其定价成本而要患者分摊。(https://www.xing528.com)
1984年,汽巴-嘉基(Ciba-Geigy)制药公司的科学家们启动了一系列寻找蛋白激酶抑制剂的项目。公司当时同意资助这个项目,但由于之前在肿瘤领域受挫,公司并不愿意在这种看似风险极大的项目上投入过多的资金和精力。激酶抑制剂只能在悄无声息的情况下进行,当时也并没有引起多少人的注意。Lydon和Matter在Ciba-Geigy公司进行激酶抑制剂研究的80年代中后期,已经有很多实验室报道了多种化合物能够产生激酶抑制作用。Lydon和Matter最大的困境并不是来源于科学研究,而是当时公司对于该研究项目的态度。慢性粒细胞白血病(CML)的研究对于制药公司来说也很难产生足够的吸引力。问题在于CML的发病率并不高,美国每年的新发患者数量只有5 000人,全球总体的发病率只有大约1/10万。在当时来说,这样的患者群体很难对制药公司产生吸引力,治疗更常见的癌种的药物会带来更大的利润。
1990年,在一个针对蛋白激酶C(PKC)的项目中,研究人员们发现一种2-苯氨基嘧啶(2-phenylamino-pyrimidine)的衍生物展现出了成药的潜力,能同时抑制丝氨酸/苏氨酸激酶与酪氨酸激酶。在这个化合物的基础上,研究人员们做了一系列的合成尝试,不断优化这一分子的特性:在嘧啶的3号位上添加的吡啶基团能增加其在细胞内的活性;苯环上添加的苯甲酰胺基团能增强对酪氨酸激酶的抑制能力;苯胺基苯环6号位的修饰进一步增强了对酪氨酸激酶的抑制;N-甲基哌嗪的侧链添加则极大地改善了这个分子的溶解度,使得口服用药成为可能。经过一系列的设计与修饰,这款分子彰显出了极高的特异性抑制能力。只要细胞表达BCR-Abl蛋白,其生长就会被这款分子抑制。研究人员相信是时候将它推进到下一阶段了。这款分子的代号是CGP57148B,后来有了一个更为响亮的名字——伊马替尼(imatinib)。
1993年,Ciba-Geigy处于领先地位的激酶抑制剂项目并不是Abl激酶抑制剂,而是另一款药物。尽管Lydon始终相信Abl激酶抑制剂治疗CML的潜力,但CML的低发病率,有限的市场空间仍然不会让公司的管理层产生什么兴趣。Lydon一直要求对伊马替尼进行进一步的研究,同样焦急等待着的,还有Druker。何时进行毒理学评价?何时提交新药临床试验申请(Investigational New Drug Application,IND)(相对于新药上市许可申请:New Drug Application,NDA)?何时药物才能够进入临床研究?焦急等待中的Druker决定进行另一种策略,以证明伊马替尼治疗CML的潜力:将伊马替尼与患者的骨髓细胞混合,并检测伊马替尼是否能够抑制CML细胞。这项研究的成功至少证明了伊马替尼能够有效地杀死人的CML细胞,而对正常人体细胞没有很大影响。有了这项研究,Lydon以及Matter就有了更加有力的证据说服管理层推进伊马替尼的临床前研究。
1995年,公司最终同意进行伊马替尼的临床前的研究。1996年的7月,他们终于拿到了第一批毒理学实验的结果。结果发现,以静脉形式接受给药的犬会在导管末端出现血凝块。该研究的失败让公司内部对于伊马替尼的信心大减。但Matter认为,如果静脉注射不成功,那么口服制剂是否能够避免毒性的产生呢?Matter告诉Druker公司之所以决定做注射剂,是因为他们错误地预计伊马替尼做成口服制剂无法有效吸收。然而如果做成口服制剂,毒理学评价又得从头开始。
1996年,Ciba-Geigy制药公司与山德士(Sandoz)制药公司合并为Novartis(诺华制药公司,简称诺华)。当诺华成立的时候,之前的很多研究项目都面临着被中止的困境。当时的诺华是不会有兴趣去开发一种市场空间不大,而且存在毒性问题的药物,更不会试图去将其推向临床研究。Lydon屡次受挫,在诺华成立之后他便辞职了。但毒理学研究仍在持续,很长一段时间内,Druker都没有从诺华那边得到什么消息。最终,消息从诺华传来,仍然是坏消息。600 mg剂量的伊马替尼能够引起犬的肝衰竭。在大鼠的研究中,更低剂量的药物也同样能够引起肝损伤。这一次出现的毒性问题同样引起了不小的震动。但Druker相信,是给药方式存在问题,而且应用的剂量比临床中应该使用的剂量要高得多。但诺华却不这么认为。就在此时,第七项毒理学实验开始了,在猴子的实验中,他们并没有发现毒性问题。与此同时,Druker直接与FDA取得了联系,告诉他们诺华已经有了足够的安全性数据提供给FDA进行审查。而FDA也认为他们已经有了足够的安全性数据。但当Druker把消息告诉诺华的高管之后,他们仍然不为所动。如果他们连FDA的建议都不采纳,还能有什么办法说服他们进行临床实验呢?Lydon当时给Druker提供了一个建议。跟诺华的高管协商,如果不愿意进行临床试验的话,可以将该项目出售。由于已经有了非常充足的前期数据,这个项目对于很多制药公司来说是非常有吸引力。Lydon也对Druker说:“他自己成立的公司很愿意收购这个项目。卖掉也总比将伊马替尼束之高阁来的好。”最终,诺华还是同意了尝试进行临床试验[14]。
从1984~1998年共15年是属于伊马替尼(格列卫)真正的研发时间,但是在这15年中其研发并没有得到公司的重视,也就是其研发的资金和人员的配备并不多,只是企业研发人员的日常工作而已,这样的研发成本是极低的。进行化合物结构设计和筛选、少量动物实验、外加几个研发人员的工资能有多高的成本呢?
1998年6月,伊马替尼迎来了历史性的一天——它终于进入了人体试验阶段。在这项1期临床试验中,研究人员们的主要目的是寻找最大耐受剂量,探索这款药物的安全性。研究招募了一群经过治疗,但病情依旧严重的患者,并让他们接受每日伊马替尼的口服疗法。研究表明该药物不但耐受良好,而且有着堪称奇迹般的疗效:接受300 mg剂量的54名患者中,有53名出现了血液学上的完全缓解(complete hematologic responses,CHR)。这一可喜的结果,迅速将伊马替尼带往了2期临床试验。1999年启动的2期临床试验再次验证了1期试验中观察到的积极疗效。更为可喜的是,这些疗效看来相当持久:在治疗的一年半后,患者的无进展生存率依然达到了89.2%。2001年,基于其出色的治疗效果,美国FDA在2期临床试验后,就加速批准这款新药问世,治疗慢性粒细胞性白血病。而这款药物的产品名,就是我们所熟知的格列卫[15]。
从1998年到2001年格列卫上市经过了4年时间,从新药研发的角度看,这4年才是真正烧钱的时间段,经过人体试验、1期临床、2期临床,因为病例的稀缺性,其临床试验的成本可能会比其他常见病的成本要高一些,但FDA最后是加速批准了该药。因此从头到尾格列卫满打满算的研发时间也不过19年,何来50年之说呢?所以说国内的报道动不动就说“研发一个新药至少10年,至少25亿美元”从何而来?有何根据?是欧美药企的误导,还是国内没有任何质疑的以讹传讹?笔者曾做了5年的新药研究,了解在中国做新药研发需要的时间和金钱成本,即使把国内的研发成本的单位直接换成美元,恐怕也不会比1亿美元高多少。如果说发明或发现一个完全新型的活性化合物其时间成本和金钱成本更高的话,也绝对到不了50亿美元,当然如果把医学教育的投入也算进去的话可能就不止50亿美元了,或许500亿美元都不够。况且舆论界把新药的定义搞清楚了吗?其分类搞清楚了吗?很多me-too、me-better药物和改变剂型和用药途径的药品也是新药。创新药物应该可以分为突破性创新药物和持续性创新药物,持续性创新药物如me-too、me-better药物、改变剂型和用药途径的新药我们可以计算出其研发成本,那些依靠单个人的“灵光一现”突破性创新的药物又该如何计算成本呢,如果不能计算而为了定高药价就可以随意编造吗?当然如果没有“灵光一现”的神来之助,即使花上100亿美元,100年时间也创造不出一个创新性新药,创新性新药靠金钱、人海战术是堆积不出来的。我们可以看一看中国本土发明的两个突破性创新性新药的例子。
青蒿素是从复合花序植物黄花蒿茎叶中提取的有过氧基团的倍半萜内酯药物,由中国药学家屠呦呦在1971年发现。2015年诺贝尔生理学或医学被授予美国、日本和中国的3位科学家,美国科学家William C.Campbell、日本科学家大村智和中国科学家屠呦呦分享了此次诺贝尔生理学或医学奖。屠呦呦因创制新型抗疟药——青蒿素和双氢青蒿素——的贡献获奖,青蒿素被誉为“拯救2亿人”的发现。中国政府于1967年5月23日在北京成立5·23抗疟计划办公室,统一领导《5·23抗疟计划》的实施,其全称为中国疟疾研究协作项,代号为“523”,集中全国医药科研力量研发治疗疟疾的新药。1977和1979年,青蒿素的研究成果在中国《科学通报》与《化学学报》上发表,同年青蒿素的分子式被美国《化学文摘》收录。1981年3月3~6日,“523”计划举行最后一次小组会议,5月该会议纪要下发,“523”计划结束[16]。整个工作持续了15年,全国大量的医药科技人员参与其中。中国中医研究院的屠呦呦研究员在研究中国医药历史文献东晋葛洪的《肘后备急方》时,看到其中将青蒿“绞汁”用药,从而得到启发产生灵感,改用低沸点的乙醚提取,保护了青蒿素的化学结构不被熬煮的高温破坏。这一创新火花的瞬间迸发宣告了不同于原有抗疟药乙氨嘧啶、氯喹、伯氨喹的全新化学结构的特效高效抗疟药的问世,在疟疾的治疗史上取得了划时代的突破。其后又开发了蒿甲醚,并开发了其他疾病的治疗。
盐酸关附甲素系中国药科大学刘静涵教授从我国传统中药关白附(黄花乌头的块根)中分离得到的具有抗心律失常活性的C20二萜生物碱。刘静涵教授主持研究的盐酸关附甲素及其注射液于2005年8月获得国家西药一类新药证书(国药证字H20051128/9)和生产批件(国药准字H20051679/80)[17]。该成果倾注了刘静涵教授20多年的心血,在笔者1990年考入中国药科大学时,就听闻刘静涵教授已经专心研究该药10年有余。1980年,刘静涵教授从关白附中分离并鉴定了关附甲素的结构,是我国在抗心律失常领域第一个自行研制并具有知识产权的一类新药。从分离并鉴定其结构,到最终完成三期临床上市,刘静涵为之倾注了25年的心血。该药的研究曾获国家医药管理局“七五”国家重点科学技术项目、“九五”国家科技部“1035”工程“项目资助、“十五”重大科技专项“创新药物和中药现代化”的资助等。中国科学院上海药物研究所和一些制药企业参与了该药的研发和产业化。
青蒿素的发现在全球抗击疟疾进程中发挥了重要作用,尤其是在疟疾重灾区非洲,青蒿素已经拯救了上百万生命。根据WHO的统计数据,自2000年起,撒哈拉以南非洲地区约2.4亿人口受益于青蒿素联合疗法,约150万人因该疗法避免了疟疾导致的死亡,其社会效益不知要超过格列卫多少倍。那么青蒿素及其衍生物的制剂价格高吗,其制剂的价格是按照研发的成本来制定的吗,其研发的成本又是多少呢,迄今为止其总销售额又是多少呢?笔者在中国药科大学读书和做科研的时候曾到图书馆查阅过当时全国协作研究青蒿素的文献资料,可谓是汗牛充栋,尽管纸质已经发黄,全国数不清的单位和研究人员的名字出现在上面。这15年时间,无数人的心血值多少钱呢?在定价时考虑过其研发成本吗?网上可以查到的有云南昆药集团的复方蒿甲醚(12片)是169元人民币,其他则没有答案。吉林敖东洮南药业股份有限公司生产的盐酸关附甲素注射液,商品名达芬齐芯,规格为2 ml∶100 mg,每盒报价42元,用于治疗阵发性室上性心动过速型心律失常。这样的价格包含了25年来刘静涵、中国药科大学、中国科学院上海药物研究所、制药企业和国家各种基金的投入成本吗?只能说中国企业或者大部分发展中国家研发的药品都是“良心”定价,既不掠夺本国人民,更不掠夺外国民众。但格列卫国内现价约为11 000元人民币,迄今为止其全球总销售额约为530亿美元,早已远远收回所谓的50亿美元成本,当然现在又有说法是格列卫的高价是因为还要摊分以后有关药品的研发成本。还要摊分未来的未知研发成本?欲壑难填啊!真是“欲卖高价,何患无辞”!
国际上对药品的定价有两种方法,分别是成本定价法和市场定价法。
成本定价法的基本公式是:药品价格=原料成本+辅料成本+包材成本+制造成本+财务成本+销售成本+税务成本+企业利润。原料成本、辅料成本、包材成本这3个成本全社会不同制药企业基本是一致的,市场上可以查得到的;制造成本和财务成本每个企业的差别是比较大的,如果企业的贷款比较多,需要支付的利息很高,那么财务成本会很高;另外医药企业基本都是高新技术企业,其研发的成本的摊销则可能在较短的时间内,如5年内,如果在摊销时间内产量很大则具体摊销到每一盒药品上则很少;制造成本还与人工、水电费用相关;销售成本也是一个变量比较大的成本,但物价部门在审定药价时往往不会允许销售费用在总成本中占比太高。笔者在近30年的从业经历中多次主持公司新药的定价事宜,深知定价的繁杂不易和利害关系。税务成本基本是根据国家规定固定比例的,企业利润的部分也不会太高,占比基本与市面上现有药品的利润持平,不然价格管理部门也不会审核同意。国内绝大部分的仿制药企业都是按照这种方法进行药品价格核定的,仿制药的定价基本在全球都是按照成本定价法进行的。
市场定价法多用于创新药的定价。主要采用参比的方法,参比的对象可以是价格,可以是患者的收入,也可以是疗效。比如价格参比法,根据市场上已有的同类药品的价格参比决定。例如,市场上治疗某一疾病目前最好的药品的价格为1 000元,现在研发的新药治疗此种疾病疗效比之高30%,或者达到同样疗效需要的时间减少30%,或者不良反应少了30%,那么该种新药的定价可以为1 500~2 000元。收入参比法是根据治疗对象的经济承受能力来决定价格的。比如某类患者的收入水平是100万,如果治愈则100万换来了原来的健康,那么该药的定价则为完全治愈需要的药品的价格则为100万,价格是由市场对价格承受能力决定的,与研发费用没有多大的关系。目前,肿瘤免疫疗法已经成为了抗癌领域的一大热点,其中最具代表性的CAR-T细胞疗法也因为能够有效治疗恶性血液肿瘤而名声大噪。2017年,诺华首个推出了有望根治弥漫性大B细胞淋巴瘤的CAR-T疗法,售价是37万美元一个疗程,包括住院费等杂费后,一次治疗的费用有望超过50万美元,合人民币350万元。疗效参比法参比的对照物可以是某药品的价格,也可以是某手术的价格,反正比的是治疗的结果,比如治疗丙型肝炎新药的定价,会参考肝移植手术的整体费用,并在此基础上打一定折扣。丙型肝炎治疗药品28片装的索磷布韦片,国内定价每瓶19 660元,患者服用一个疗程需要花费近6万元;丙通沙在中国的定价还未公布,在英国,12周的治疗价格约5.1万美元,美国则是7.4万美元,合计人民币分别为35万和52万元。
欧美制药企业为原研药制定很高的价格,常常用高投入的研发费用作为支持依据,这样可以在舆论宣传上站在理论和道义的制高点;另外,很重要的一点是研发费用往往无法追溯查证,自己关起门来说自己的研发成本很高别人也没有办法去一一质疑,再加上欧美大国把持着国际舆论,发展中国家又能如之奈何。用市场定价法产生的药品价格向公众宣导时宣传为根据成本定价具有一定的蛊惑性和煽动性。但这两种定价方法本身并无方法上的优劣,也无须进行道德上的评价,只能说面对威胁生命的疾病,作为患者的个人只能根据个人的经济情况进行选择,“姜太公钓鱼,愿者上钩”,但是作为具有公共管理职能的国家则需对自己国民的健康负有一定的责任,要为这个国家未来的发展包括医药行业的发展争取利益,谋篇布局,进行长远规划。
面对高高在上的药品价格,特别是欧美企业研发的高价抗癌药品,再看看国内居高不下的癌症发病率和日日处于水深火热之中的癌症患者及其家属,我们有什么办法呢?有人说为什么不向印度学习呢?印度的一些做法确实值得我们学习,但不能模仿,因为国情不同,时代也不同了,有些时机错过了就永远也找不回来了。解决办法要从政府和个人两个层面来寻找。从政府层面来说主要是制定合理又合用的政策,促进国内抗癌药品的可及性和经济性,但这需要一个过程。制定政策的高层级领导人不能只是专家,还必须是政治家,所谓的政治家是指除了专业之外更要心系基层百姓,造福普通百姓,而不能仅仅只考虑某一些小众的利益集团,要有人民立场,能把民众的健康和幸福置于各种利益的纠缠之上。他们的品德一定是第一位的,必须首先要正直,公正无私,要有宏观和长远眼光。这几年药监局系统一直是巨震不断,自国家药监局局长郑筱萸被执行死刑开始,药监局一直都在反腐的漩涡之中。根据统计,自2016年6月到2018年6月两年之中“落马”、宣判的药监官员,就多达40人[18]。2018年8月16日,因长春长生疫苗案中央要求毕井泉(市场监管总局党组书记、副局长,2015年2月至2018年3月任原食品药品监管总局局长)引咎辞职;要求焦红(国家药监局局长)作出深刻检查;中央纪委国家监委对吴浈(原食品药品监管总局副局长、原卫计委副主任,分管药化注册管理、药化监管和审核检验等工作)进行立案审查调查。2019年2月26日,原国家食品药品监督管理总局副局长吴浈涉嫌滥用职权、受贿一案,由国家监察委员会调查终结,移送检察机关审查起诉,最高人民检察院依法以涉嫌滥用职权罪、受贿罪对吴浈作出逮捕决定。在豫剧《七品芝麻官》中有一句台词:“当官不为民做主,不如回家卖红薯”,可惜的是有的药监局官员现在连“卖红薯”都没有机会了。面对高价药品,从个人层面就是要想办法解决现实的问题,寻求国外原研或仿制的抗癌药品的代购,这能解决癌症患者当下的困难,当然这个代购必须是合法的,代购的药品也要保证必须是真的才行。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




