二、代谢工程的应用
1.高产乙醇大肠杆菌的重组与构建
1987年,世界上第一株高产乙醇大肠杆菌基因工程菌问世。这对非乙醇生产者的肠道细菌构成成功是很有意义的。它采自移动发酵单胞菌的丙酮酸脱羧酶基因Pdc和乙醇脱氢酶基因adh构成Pet人工操纵子,插入到PUC载体上形成重组质粒PLO1295,并转化大肠杆菌。该重组质粒以葡萄糖为原料,在氨苄青霉素的存在下发酵产生34g/L的乙醇。1991年,美国佛罗里达州立大学的展品和农业科学学院构建了一株品质优良的大肠杆菌(Koll)。这种重组大肠杆菌的染色体上整合有移动发酵单胞菌的Pdc和adhB基因,从含有10%葡萄糖和8%木糖的发酵培养基中可分别获得54.4g/L和41.6g/L乙醇。这种产乙醇的重组大肠杆菌还能发酵除葡萄糖和木糖外的所有木质纤维素类物质的其他组分,如甘露糖、阿拉伯糖和半乳糖。目前,各种优化大肠杆菌Koll工程的研究工作仍在继续进行,其中包括改善Pet重组操纵子的遗传稳定性以及进一步拓展工程菌发酵底物的范围等内容。
2.谷氨酸工程菌的构建
谷氨酸工程菌株筑建,主要采用载体质粒将目的基因导入。早在20世纪80年代初,Tsuchida等人利用谷氨酸的产量为5.5g/L的乳酸发酵短杆菌,采用鸟枪法将染色体DNA的某些酶切片段插入到载体质粒PAM330中(质粒DNA大小为4.6kb,拷贝数10~14),然后利用转化法将该重组质粒分别导入到两株乳糖发酵短杆菌的宿主细胞中,构建出谷氨酸工程菌。该工程菌经发酵培养48h,谷氨酸产量分别达到9g/L和9.8g/L。
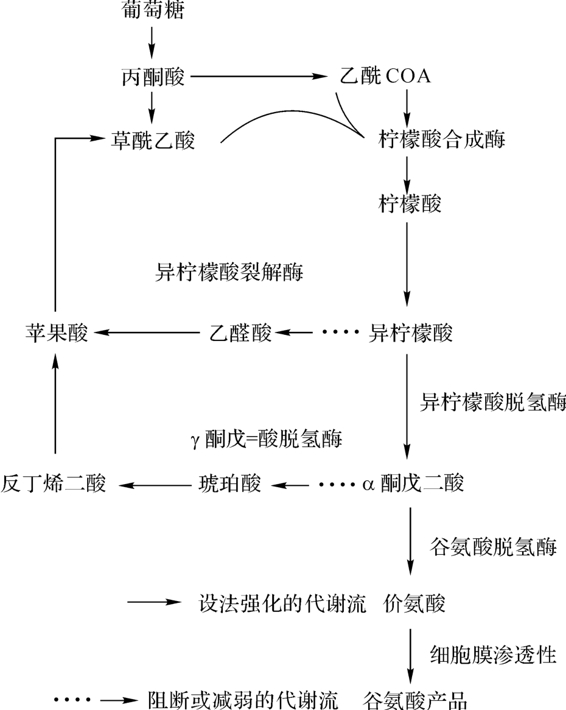
图7-13 谷氨酸工程菌的构建战略
1986年,Watanabe等人将谷氨酸脱氢酶基因克隆到载体质粒PAM330中。为了解除谷氨酸对谷氨酸脱氢酶的反馈调节,他们对该重组质粒进行体外羟胺诱变后,再转化到谷氨酸产生菌乳糖发酵短杆菌中,构建出谷氨酸工程菌。这个工程菌株在最佳条件下进行500L罐发酵,谷氨酸产量可达54.6g/L。图7-13为谷氨酸工程菌的构建战略。谷氨酸产品的原料是葡萄糖,经糖酵解转入TCA循环,通过代谢流的强化与阻断,使正常的乙醛酸和三羧酸循环减弱,但柠檬酸的合成途径畅通,谷氨酸对谷氨脱氢酶反馈不敏感,导致谷氨酸大量积累。
1993年Nobuharu等报道,运用大肠杆菌谷氨酸分解代谢缺陷、谷酰胺缺陷,以及γ-酮戊二酸脱氢酶缺陷的埃希氏杆菌进行谷氨酸发酵,通过ace操纵子的组成型表达,可使谷氨酸的产量得到提高。首先,他们通过诱变得到一株不能利用谷氨酸的埃希氏杆菌突变株,并且表现出缺乏α-酮戊二酸脱氢酶的活性。然后,将一组成型的ace操纵子导入宿主细胞,使该菌株的异柠檬酸脱氢酶活性提高了15倍,再把此菌株培养在含有葡萄糖、无机盐和酵母抽提物的培养基上,并补充甲硫氨酸和赖氨酸0.1g/L;在37℃培养20h,此工程菌株的谷氨酸产量为20.0g/L。
1995年,日本Asakara Yoko等将乳酸发酵短杆菌ATCC13869的α-酮戊二酸脱氢酶基因分离出来,并测出氨基酸序列。然后通过体外定点突变改变此基因,钝化α-酮戊二酸脱氢酶的活性,从而构建了一株谷氨酸工程菌,在发酵过程中,再添加过量生物素或表面活性剂或青霉素方法,使此菌株的谷氨酸产量得到很大提高。另外,日本亦有利用大肠杆菌构建出α-酮戊二酸脱氢酶和磷酸烯醇式丙酮酸羧化酶渗漏突变株进行谷氨酸发酵。由于α-酮戊二酸脱氢酶和磷酸烯醇式丙酮酸羧化酶活性的降低和减弱,也相应地提高了谷氨酸脱氢酶的活性,从而使谷氨酸大量积累。

图7-14 肌苷工程菌的理想合成途径
3.肌苷工程菌株的构建
核苷酸的生物合成途径有两条:一是利用葡萄糖等碳源和氮源,以5′-磷酸核糖为起点的合成途径;二是由嘌呤碱基由于核糖基化和磷酸化而合成的补救途径。要构建肌苷工程菌株,就必须满足以下条件:①具有有效的5′-核苷酸酶;②将肌苷分解为次黄嘌呤的核苷酶活力降低或丧失;③解除菌体自身所受的代谢控制;④增加前体物,阻断代谢支路。因此,肌苷工程菌的理想生物合成途径如图7-14所示。葡萄糖经HMP途径产生R5P经核苷酸合成途径至氨基咪唑核苷酸(AICAR),阻断支路、保持肌苷(IR)合成,并阻断生成AMP和GMP两条互换的环行路线而生成腺苷酸和鸟苷酸。具体操作如下:
(1)寄主——载体系统的选择
生产株菌为枯草芽孢杆菌(Bacillus Subtilis),在构建肌苷工程菌株时,载体DNA多采用能在芽孢杆菌菌体中进行自我复制的质粒或噬菌体。为把染色体DNA片段与载体连接,一般采用T4DNA连接酶进行连接的方法,也可利用染色体片段和开环载体DNA分别进行同聚物加尾后再退火连接的方法。重组质粒多采用经典的转化法导入到受体菌中。另外,还可以利用体外诱变的方法,使肌苷生物合成中的关键酶如SAMP(琥珀酸肌苷酸)合成酶、IMP脱氢酶基因发生缺失,然后再将该片段转化到受体菌中,从而获得遗传性状更为稳定的肌苷工程。
(2)强化代谢流
肌苷生物合成的最初前体物质是5-磷酸核糖,为了大量积累R5P,必须切断HMP途径,其关键是使细胞丧失转酮酶活力,从而阻断由该酶所催化的反应,使反应前体物R5P大大积累。Iwadate(1991)等人首先将枯草芽孢杆菌染色体DNA中的转酮酶基因克隆到载体质粒PUB110中,然后,将氯霉素酰基转移酶基因插入到酮酶基因中,造成转酮酶基因的不可逆失活,经限制性内切酶Smal酶切后得到线状重组质粒,将此重组质粒转化到枯草芽孢杆菌宿主中,构建出转酮酶失活的肌苷工程菌株,其肌苷积累量达52g/L。
PRPP(磷酸核糖焦磷酸)转酰胺酶作为肌苷生物合成中的关键酶,起着肌苷生物合成的限速作用。如果将枯草芽孢杆菌染色体DNA的PRPP酶基因克隆到高拷贝数的载体中,使该基因大量扩增,其结果所构建的工程菌株的肌苷积累量大幅度提高。
近些年来,我国张蓓等(2003、2004)开展了肌苷、鸟苷代谢途径分析。如在肌苷高产枯草芽杆菌中,将代谢流作为一个关键性的变量来测定,利用得到的实验数据包括葡萄糖的消耗速率和代谢主产物以及副产物的形成速率,利用代谢通量平衡模型,由此得到EMP、TCAC和PP途径的代谢流,并对其进行了分析。
(3)阻断竞争代谢支路
如图7-14所示,若构建丧失SAMP合成酶的菌株,可以切断IMP→SAMP的代谢支路,又可以通过限量添加腺嘌呤,从而解除腺嘌呤对关键酶PRPP转酰酶的反馈抑制和阻遏,有利于肌苷的直接前体物IMP的积累。如构建丧失IMP脱氢酶和XMP转氨酶的菌株,可以切断IMP→XMP→GMP(肌苷酸、黄苷酸、鸟苷酸)的代谢支路,同时又可以通过限量添加黄嘌呤或鸟嘌呤,以解除GMP对PRPP转醛胺酶的反馈抑制。
Sumino等人(1988)用限制性内切酶BglⅡ和Bam HⅠ分别处理枯草杆菌NO115染色体DNA,分别将限性内切酶酶切片段转化到枯草杆菌BM1032(SAMP合成酶缺陷突变株),经选择,确定SAMP合成酶基因长度为6.7~8.5kb,然后将基因片段连接到质pBR322中,获得重组质粒pPA350。
另外,将带有氯霉素酰基转移酶基因(Cat)的质粒PC194 HpaII-San 3AI片段连接到载体质粒Puc19中,转化到大肠杆菌MM294中,选择具有Ampr和Chlr的转化子,获得了1.1kb的具有氯霉素酰基转移酶基因的片段。经T4DNA聚合酶处理,使其黏性末端变为平滑末端。再用限制性内切酶Hpal处理重组质粒pPA350,然后使氯霉素酰基转移酶基因连接到该质粒Hpal切点上,使SAMP合成酶基因失活获得重组质pPA350-1。又将质粒pPA350-1用限制性内切酶PvuⅡ处理,得到在SAMP合成酶基因序列中插入了氯霉酰基转移酶基因的DNA片段(10.5kb)。最后,将该DNA片段转化到枯草杆菌NA6128R中,获得了肌苷工程菌株NA6201。该菌株不仅带有SAMP合成酶缺失突变,同时还附加有氯霉素抗性标记。该菌株在葡萄糖与氢素及无机之素培养基下,于37℃发酵培养96h,肌苷产量可达24.3g/L,有副产18.2g/L鸟苷。
4.D-核糖工程菌的构建
D-核糖生物遗传物质核糖核酸(RNA)的组成部分,并在机体生命活动中起着非常重要作用。它在医药中可用于合成维生素B2和制备多种核酸药物之用。核糖的生物合成途径是磷酸戊糖途径,而通过调控获得,如通过核糖工程菌的构建、产量将显著提升。目前所用的D-核糖生产菌株大多数为枯草芽孢杆菌(Bacitlus subtilis)和短小芽孢杆菌(B.pum ilis)。
(1)调节酶学的反应速度
D-核糖是由葡萄糖经HMP的氧化性途径生成,如何提高葡萄糖磷酸激酶和脱氢酶活性,对提高D-核糖产量是很重要的,早在1986年有人论述了葡萄糖操纵子的基因结构,通过修饰启动子和gatR的结构,可以使葡萄糖酸激酶得到高表达。1992年,Miyagawa等用克隆葡萄糖操纵子构建出D-核糖工程菌。首先用限制性内切酶ECORI处理的噬菌体Zap感染大肠杆菌BB4,用标记核酸探针进行杂交,获得了具有高葡萄糖酸激酶活的核糖生产菌Bacillis subtilis pGLS4。该工程菌可积累核糖62mg/ml,而亲株只积累39mg/ml的D-核酸。再者,小林等人将葡萄糖脱氢酶基因克隆到穿梭载体质粒P某编号中,然后转化到枯草芽孢杆菌中,构建出D-核糖工程菌株。结果使受体菌中葡萄糖脱氢酶的基因活性大幅度提高,经35℃发酵80h,可积累49g/LD-核糖。
(2)改变代谢流
按照HMP途径生成R5P和D-核糖积累,必须使7-磷酸景天庚糖转酮酶和磷酸核酮糖异构酶失活。研究表明,枯草芽孢杆菌和短小芽孢杆菌的转酮酶缺失突变株能够大量积累D-核糖。Lwadate等人首先将枯草芽孢杆菌染色体DNA中的转酮酶基因克隆到载体质粒PuB110中。然后,将氯霉素酰基转移酶基因插入到转酮酶基因中,造成转酮酶基因的不可逆失活。经限制性内切酶Smal酶切后得到线状重组质粒,将该线状重组质粒转化到枯草芽孢杆菌宿主中,构建出转酮酶失活的D-核糖工程菌株,其D-核糖积累量达52g/L。
在D-核糖的生物合成途径中,R5P是5-磷酸核酮糖差相异构酶和5-磷酸核糖异构酶竞争对象。将枯草芽孢杆菌中5-磷酸核酮差相异构酶的基因转移到质粒中,通过外源基因的插入,使此基因失活,以减少R5P向D-木糖-5-磷酸的转变,为D-核糖的合成提供更多的前体物质。
5.重组大肠杆菌的高密度发酵
在工程菌的发酵中,外源基因高表达条件下的高密度发酵对于提高生产效率,降低生产成本,简化产品纯化工艺等具有非常重要意义。然而,在大肠杆菌的高密度发酵中遇到了许多困难,其中包括有机酸类代谢副产物积累并抑制细菌自身生长,供氧限制和外源基因高表达引起宿主细胞生理负担过重等问题。目前,可采用的几项代谢策略如下:
(1)阻断乙酸产生的主要途径
已知大肠杆菌产生乙酸的途径有两条:一是来自丙酮酸由氧化酶的作用直接产生乙酸,但为数不多;另一条是在乙酸激酶(ACK)和磷酸转乙酰基酶(PTK)的作用下将乙酰CoA转化为乙酸,这是大肠杆菌产乙酸的主要途径。Bauer等利用乙酸代谢突变株对氟乙酸钠的抗性由大肠杆菌MM294筛到了一株突变株MD050。用摇瓶和14L发酵罐进行的发酵实验表明,PTA缺陷株的生长速率并未减缓,但乙酸的分泌水平却明显降低。但有试验表明PTA和ACK的突变无论在好氧还是厌氧方面均对大肠杆菌的代谢产生不利的影响,推测造成这种不利影响的原因可能是乙酰CoA的积累。从TCA循环看,乙酰CoA积累将影响丙酮酸脱氢酶的活性,造成丙酮酸的积累。丙酮酸会直接分泌出来或还原为乳酸。乙酰CoA积累还会造成NADH的再生途径受到抑制,而引起NADH的积累,结果通过抑制磷酸甘油醛脱氢酶的活性引起糖酵解速度的下降。由此可见,乙酸的减少不只切断了乙酸产生的主要途径所致,还可能通过降低葡萄糖的摄取来降低乙酸的产生。(https://www.xing528.com)
(2)降低糖酵解途径上的碳代谢流
试验表明通过限制糖酵解途径上的碳代谢流来降低乙酸分泌的代谢工程手段应当是有效的。在这方面有两种方法:一是通过代谢工程手段改变大肠杆菌对葡萄糖的摄取速度;二是将摄入细胞的葡萄糖以一定方式如生成糖原的形式储存起来。
大肠杆菌对葡萄糖的摄取是葡萄糖磷酸转移酶系统(PTS)的作用下通过基因转移进行的。Chen等(1994)用P1噬菌体转导,由大肠杆菌PPA305获得PTS缺陷菌株PPA316,用半乳糖、质子同向运输系统代替PTS进行葡萄糖的摄取,结果缺陷株比生长率有所下降。PPA316菌株比PPA305菌株在有氧条件下获得最大的细胞密度提高了8%,而在厌氧条件下降低了14%。根据检测表明,PTS缺陷株的细胞内在发生了很大变化,包括磷酸化糖、NADH、ATP和DEP的水平下降而ADP水平上升,由此认为突变株的代谢调控是复杂多变的,并非都按设想而定。
已知乙酸是碳代谢过量引起的,那么把碳代谢流引向糖元合成,变成一种碳源储存形式,在适当时候加以利用,这是常见的一种生理现象。Dedhia等采用了两种代谢工程策略都使大肠杆菌的糖元得到过程的积累,但乙酸的分泌水平并未因此降低。他们还构建了控制糖元合成和分解的“代谢转移开关”,在一定发酵时期向培养基中加入诱导物,则可以关闭糖元合成操纵子,使细胞由糖元的合成代谢转向分解代谢。总之,从理论上分析,以代谢工程降低大肠杆菌乙酸分泌的最佳位点是通过引入基因过量表达PEP羧化酶和增强乙醛酸循环,使乙酸的生成减少,但生物量仍保持在原来的水平上。这种途径产生的NADH较少,所以,在氧化磷酸化水平不变的条件下,可消耗更多的碳源,从而起到了分流作用,降低了乙酸的毒副产品的生成。
参考文献
1.JamesWO.Plant Respiration.London:oxford Univ.press,1953
2.Krebs HA,et al.The tricarboxylic acid cycle.ln Metabolic Pathway.Vol.1(Ed.Greenberg DM)Academic Press,1960
3.Davies J,et al.Elementary Biochemistry:An Introduction to the Chemistry of Living Cells.Prentice-Hall,inc,1979
4.Smith EL,et al.Principle of Biochemistry:General Aspects,London:McGraw-Hill BooKCo.1983.
5.沈同,王境岩.生物化学(第二版下册).北京:高等教育出版社,1991
6.汤佩松.高等植物呼吸代谢途径的调节控制和代谢与生理功能间的相互制约.植物学报,1979,21(23):93—106
7.Yen LF,et al.Studies on plant respiration V1.The utilization of acetate in rice seedlings.SCIENTIASINICA,1964,8(8):1265—1273
8.Roberts EH.Seed dormancy and oxidation process.Symp.Soc.Exp.Biol,1969,23:161—163
9.Guan Kanglin.Studies on complex dormaney of Cornuso f f inalis seed.Chinese J.Bot,1991,3(2):145—150.
10.姚汝华.微生物工程工艺原理.广州:华南理工大学出版社,1996
11.姜成林,徐丽华.微生物资源开发利用.北京:中国轻工业出版社,2001
12.杨汝德.现代工业微生物.广州:华南理工大学出版社,2001
13.詹晓北等.食用胶的生产、性能与应用.北京:中国轻工业出版社,2003
14.吴森林等.黄胞杆菌多糖胶的生产与应用.应用微生物,1986,4:9—17
15.徐世艾.黄原腋的制备.食品与发酵工业,2000,26(5):56—61
16.王安利等.海藻多糖生物活性研究新进展.海洋科学,2002,26(9):36—39
17.王璐等.琼脂的研究与进展.海洋科学,1998,(4):34—37
18.罗伟等.香菇多糖的进展.食品与发现工业,200,26(4)63—67
19.李欣等.24种豆科植物种子的半乳甘露聚糖胶的分析.植物学报,1980,22(3):302—304
20.朱正华等.壳聚糖的制备与应用.科学通报,2003,19(6):521—524
21.夏文水等.甲壳素酶学研究现状.生物工程进展,2000,20(5):521—524
22.李元.基因工程药物.北京:化学工业出版社,2002
23.张蓓.代谢工程.天津:天津大学出版社,2003
24.Bailey JE.Toward a Science of metablolic engineering.Science,252,1668—1674
25.Stephanopoulos G,Vallino TJ.Network rigidity and metabolic engineering in metabolite overproduction.Science,252,1675—1681
26.Cameron DC,Tong IT.Celluar and metabolic engineering.Appied Biochemistry Biotechnology 38,105—140
27.Stephanopoulos GN等.代谢工程原理与方法.赵学明等译.北京:化学工业出版社,2003
28.Jorgenson H,et al.Metabolic flux distributions in Penieillium chrysogenum during cultivations.Biotechnology and Bioengineering,1995,46:117—131
29.高红亮等.杂交瘤细胞的代谢流量分析.生物工程学报,2000,6:740—746
30.Zhang Bei,etal.Anatysis of metabolic fluxes in Batch cultures of inosine-overpro-ducing Bacillus subtillis.南开大学学报(自然科学版),2003,36(3):116—122
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




