三、放氢相的人工模拟
近几十年来,光合放氢的人工理化相模拟和人工生物膜相模拟试验与构思有各种各样的水光解方式吸引着人们去探索,但都未有重大突破。
1.用无机半导体模拟
一些无机化合物作为半导体催化剂,如氧化钛(TiO2)、氧化锌(ZnO)、氧化坞(WO2)来模拟植物叶绿体的光解水:
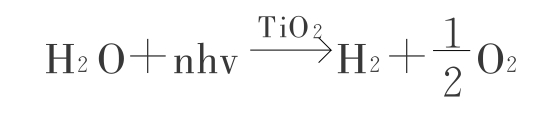
利用这些物质的粉末在水中照以紫外光(它们是白色的,不吸收可见光),在电子受体,如KMnO4、铁(Fe3+)、铁氰[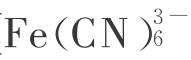 ]、笨醌等存在时能放O2。
]、笨醌等存在时能放O2。
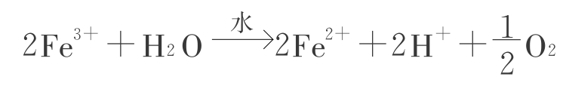
用18O2标记的水证明氧是从水光解释放的。这些结果可用装置一个电池来证实:一个电极用TiO2的晶体或“膜”,另一个电极用铂黑,中间是水,外面加低电压连接起来,当用光照TiO2电极时,那里就放O2,而铂黑电极上则放H2。量子效率约0.1。后来有人用TiO2的单晶体一电极,铂为另一电极,加上0.25伏的低电压,照光也得到H2和O2,比例2:1,储能效率约为1%。
TiO2不仅是光解水放O2和H2,还能催化一些其他化学变化。例如,TiO2可以敏化一些无机物的光氧化,如汞(Hg-HgO)和氰(CN--CNO--);还能使不饱和的氢化物还原,如乙炔的还原,产生CH4、C2H4、C2H6。更有意思的研究资料表明TiO2粉未吸水照光,在氩气(Ar)中能放H2和O2;如在有氮气存在时,则只放氧、不放氢,同时把氮还原为NH3和N2H4。
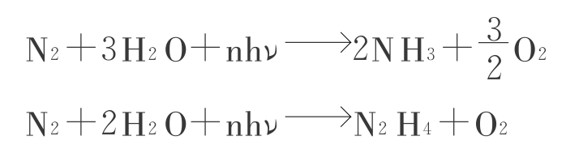
TiO2粉未加热处理或掺入铁或其他金属都能提高反应的效率。这个系统也是人工固氮的例子。据报道,用半导体(TiO2)电报转化放H2能量效率可以达13%。
2.人工生物膜模拟
用人工的双磷脂膜来模拟生物模的功能分外受人注意。它可视为一种液体晶体,也有许多类似半导体性质,且有半透性,近似于细胞膜;有些地方质子和电子可以通过造成膜两面的电荷和质子浓度差,使它可以分别进行反应。结合到光解水的问题,植物叶绿体中的放氧和还原物的产生可能就是这样分开的。
Calvin等(1979—1983)完全用人工脂膜系统及催化剂进行水光解分别收集氧和氢的试验。他们用这种膜包起的小囊泡、膜上加光敏剂,如Ru(bipy)32+的复合物。膜的外表面附上一个电子受体,如庚子精(heptyl viologen)和一个胶体铂(Pt)的催化剂;膜的内表面有两种电子供体。一个是消耗性的EDTA,在反应时被分解掉,另一个是水溶性的Ru(bipy)33+络合物,它可以积累电荷去氧化水放出O2(图6-13)。他们曾用锌卟啉作敏化剂,用锰卟啉作供体,发现氧化的锰在有适当的催化剂时能氧化烯类或水。他们还设计了一束双脂膜管,如在海水脱盐或制人工肾所用的,利用太阳光能分解水,内外分别收集O2和H2。
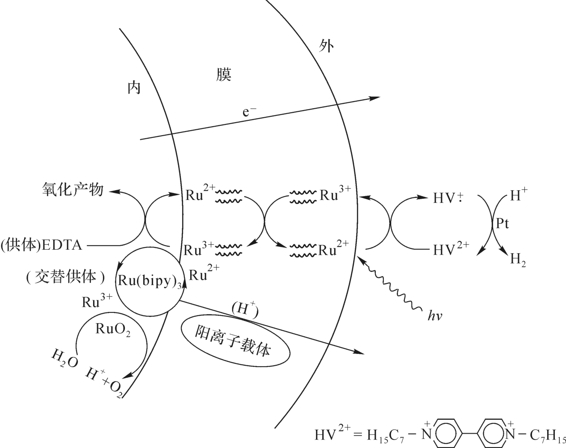
图6-13 通过人工脂小囊泡膜的光敏化的电子转移
(Calvin canj chem,1983)
JW Peter(1998)等人提出光合放氧与放氢的人工酶结合,在温和条件下使水转化成氧气和氢气的设想(图6-14)。也就是说,模拟生物酶的放氧作用,其放氧中心的Mn簇的结构已被提出,使之催化放氧,进而再利用放氧过程中释放出的四个质子,通过氢酶(Fe4S4-F2S2或人工模拟酶)还原成氢。所以,未来的放氢相人工模拟将有可能集中在放氧中心人工模拟与放氢人工酶的研究与相结合的效应上进行。这无疑是一项重大而艰巨的任务。
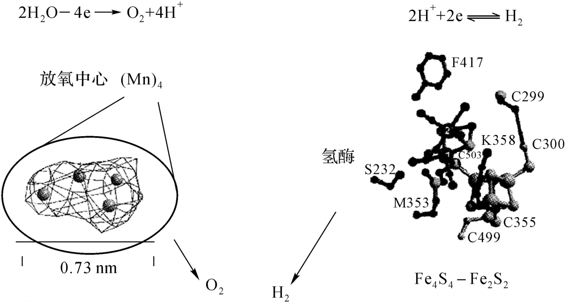
图6-14 放氧与放氢人工酶结合实现在温和条件下使水转化成氧气和氢气
参考文献
1.曹宗巽.吴相钰,植物生理学.北京:人民教育出版社,1980(https://www.xing528.com)
2.沈允钢.光合作用研究进展.北京:科学出版社,1976
3.Calvin Metal.The Photosynthesis of Carbon Compounds.New York:Academic Press,1962
4.Hatch MDetal.The Biochemistry of Plant Photosynthesis.New York:Academic Press,1980
5.Hall DO,Rao KK.Photosynthesis.Sixth edition,Cambridge Universitry Press,1999
6.Salisbury FB,Ross CW.Plant physiology.Belmont:Wadsworth lnc,1992
7.匡廷云.光合作用:原初光能转化过程的原理与调控.南京:江苏科学技术出版社,2003
8.韩博平等.藻类光合作用机理与模型.北京:科学出版社,2003
9.Wollman FA.State transitions reveal the dynamics and flexibility of the photosynthetic apparatus.EMBOJ.2001,14:3623—3630
10.刘贤德等.植物光合机构的状态转换.植物生理与分子生物学学报,2006,32(2):127—132
11.Zhenfen Liu et al.Crystal Structure of Spinachmajor light-harvesting Complex at 2.72A°resdution.Nature,2004,428:287—291
12.沈允钢,王天铎.光合作用——从理论到农业.上海:上海科学技术出版社,1978
13.许大全.光合作用效率.上海:上海科学技术出版社,2002
14.Ku MSB,etal.High-levelexpression ofmaize phospnoenol Pyruvate Carboxylase in transgenic rice plants.Nat.Biotech.1997,17:76—78
15.焦德茂.运用光合作用机理揭示生理育种途径.北京:中国农业出版社,2002
16.邓启运,袁隆平等.超级杂交稻模式株型的光合优势.作物学报,2006,32(9):1287—1293
17.汤佩松.光合、固氮、放氢——太阳能生物转换的调节与控制.生物科学动态,1979,1:1—8
18.殷宏章.植物气体代谢.北京:科学出版社,1990
19.Benemann JR.Hydrgen Praduction by microalgae.Journal of Applied Phycology.B:Biology,2000,12:291—300
20.Melis A,et al.Hydrogen Production:Green algae as a Source of energy.Plant Physiology,2001:740—748
21.Peters JW,et al.X-ray crystal structure of the Fe-only hydrogenase from clostridium pasteu rianum to 1.8 angstron resolution.Science,1999,282:1853—1859
22.管英富等.微藻光生物水解制氢技术.中国生物工程杂志,2003,23(4):8—13
23.曾晓波,王海英.微藻生物制氢技术.实用技术,2005,5:60—63
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




