二、固氮作用机理
1.固氮能量与反应式
从热力学来看,N2与H2合成NH3虽然是放能的,但活化N2的三键需要很多能量,生物固N2是由ATP水解供应能源。假定每转移一个电子需要2分子ATP,则从N2到NH3要转移6个电子,耗用12个分子ATP,可用下式表示之:
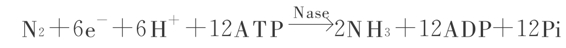
由于生物固氮伴随着氢的释放,所以,更好采用下式:
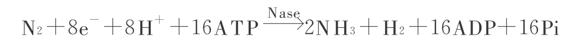
其中,3/4的能量用于固氮,1/4的能量用于放氢。
2.固氮酶的偶联机制
已知固氮酶由两个不同蛋白质组成,但如何偶联进行氧化还原催化反应?英国Postgate(1982,1992)以克氏肺炎杆菌(Klebsialla pneumoniae)为例,最先提出一个固氮酶催化机理模式。随之,各种相类似图解模式也被提出,主要在蛋白酶与MgATP的结合催化形式上更加形象,其原理与要点是一致的。目前,普遍接受的固氮酶催化的机制是Thorneley和Lowe根据固氮酶反应的动力学提出的Thorneley-Lowe模型,由铁蛋白的氧还循环和钼铁蛋白的氧还循环两部分组成。以下以简化式表示之(图5-3)。
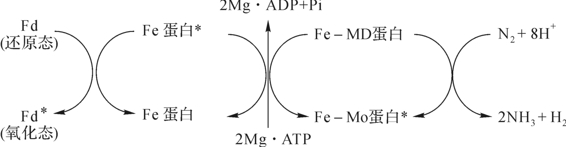
图5-3 固氮酶催化机理简化式
铁蛋白的氧化-还原循环:铁蛋白首先接受电子供体(Na2S2O4、铁氧还蛋白、黄素氧还蛋白)传来的电子变成还原态的铁蛋白;还原态的铁蛋白与2个分子的MgATP结合;结合MgATP的还原态铁蛋白与钼铁蛋白形成复合物;MgATP水解为MgADP和Pi,电子传递;铁蛋白与钼铁蛋白离解;铁蛋白接受电子供体的电子再次还原,MgATP替换为MgADP,开始新一轮的氧化-还原循环。还原1分子的N2生成2分子的NH3需要进行8次的铁蛋白的氧化-还原循环。
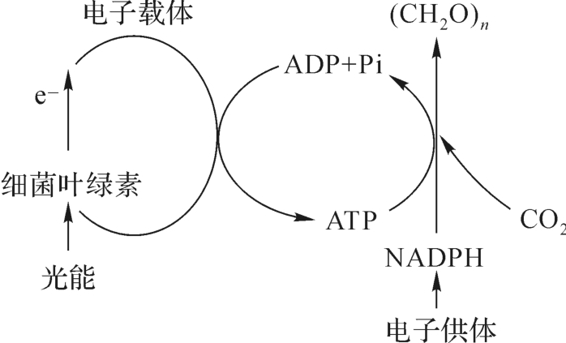
图5-4 红螺菌光合作用(https://www.xing528.com)
钼铁蛋白的氧还循环:N2的还原需要8个电子和8个质子,与铁蛋白的氧还循环相对应,钼铁蛋白也需要进行8次循环。N2的还原是逐步的过程,固氮酶放出一个分子H2后,FeMo-Co处于更加还原的状态(E3),才能结合N2分子并将其还原为NH3。
3.固氮酶的多样性
在Bishop等发现第二套固氮系统以前,人们一直认为,钼铁蛋白和铁蛋白组成的固氮酶系统是固氮生物中起固氮作用的唯一系统。Bishop在对棕色固氮菌的研究中,发现存在另外一种固氮酶系统,使生物体在缺乏Mo的条件下可以固氮生长。这种含钒(V)固氮酶只在无Mo而有V的条件下表达,由VFe蛋白和Fe蛋白22组成,被认为是一种“备份”的固氮酶系统。Fe蛋白22由vn f H编码,分子量为64kD,结构和功能均与含钼固氮酶的铁蛋白类似;两者之间的同源性达90%。钒铁蛋白的结构特性和钼铁蛋白相似,但除α2β2外,还含有一个小的δ亚基,组成α2β2δ2六聚体。VFe蛋白含有一个与FeMo-co类似的FeVCo活性中心和一个与MoFe蛋白中具有相似波谱特性的P2簇。在催化氮还原的过程中,与含钼固氮酶相比较,含钒固氮酶的催化过程释放更多的H2,消耗更多的MgATP。但是,含钒固氮酶在低温条件下比含钼固氮酶更具有活性,从而在进化过程中得以保存。
第三套固氮酶系统是铁铁固氮酶,其固氮活性极低,由FeFe蛋白和Fe蛋白23组成。Fe蛋白23与含钼固氮酶系统中的Fe蛋白的氨基酸序列同源性只有60%;FeFe蛋白与VFe蛋白在α和β的氨基酸序列同源性为55%,与MoFe蛋白的同源性只有32%。
这三套固氮酶分别由nif、vn f及an f基因簇调控,它们的固氮能力表现为含Mo酶>含V酶>仅含Fe酶。除了上述三套固氮系统外,Gadkari等发现在Strpomyces thermoauophicus存在一个与已知的三种固氮酶体系明显不同的固氮体系。这一固氮酶体系的两个组分对氧都不敏感,反而需要依赖O2或者超氧自由基发挥固氮作用。另外,该体系固定1分子N2最少仅需要4个MgATP,可见这一体系具有极高的固氮效率。不同固氮酶系统的研究,为研究生物固氮提出了一系列生理生化、遗传与进化等方面的问题,对这些问题的研究将有利于揭开固氮酶催化的机制。
4.光合与固氮关系
固氮菌的发生是很古老的,当时原始地球还缺少游离的O2。氧是绿色植物与藻类通过光合作用对水的光解产生的。被子植物兴起在中生代白垩纪。土壤中的某种细菌性固氮菌是如何进入豆科植物根部细胞形成共生根瘤,并适应进化成根瘤菌。所以,根瘤固氮酶的适应机制出现了放氧光合和固氮作用的复杂结构的时空分隔而在蓝藻中出现营养细胞和异形细胞的分化功能。
光合与固氮关系可归纳为三类:
第一类是光合厌氧生物,如深红红螺菌(R.rubrum),由于红螺固氮菌的光合作用不放氧(图5-4),也不存在内源产生氧的问题。但它含有细菌叶绿素,相当于光系统Ⅰ(PSⅠ),吸收光能进行电子传递,由环式磷酸化产生ATP能量。这里的基本电子供体不是水而是H2 S、硫代硫酸盐、H2或有机物,并通过NADPH与ATP偶联还原CO2到糖水平。红螺菌既能光合自养也光合异养,将固氮与光合作用得到偶联。固氮酶的合成以及ATP与NADPH的产生都需要光。
第二类蓝藻,如鱼腥藻,它具有营养细胞和异形细胞。营养细胞有PSⅠ和PSⅡ,因此,它能固定CO2和放氧。这些异形细胞是固氮的主要场所,虽含有细菌色素,但缺少PSⅡ,因此不能放氧,也不能还原CO2。但是,它们能进行光合磷酸化作用,生产足够的ATP以保证固氮酶活性的最大需要。这两类细胞的分工合作是生物光合和固氮双重作用的进化适应(图5-5)。
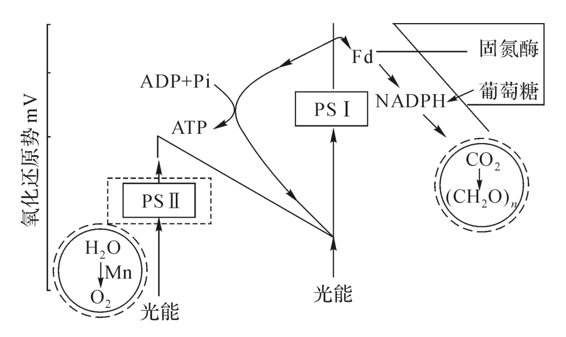
图5-5 鱼腥藻的光合与固氮关系
(三个虚线部分为异形细胞所缺乏)
第三类是豆科植物根瘤菌。豆科根瘤的共生固氮很专化,其中宿主具有强大的光合作用机构供给共生微生物所需要的碳水化合物并在交换中接受铵,使根瘤菌得以集中全力固氮。但是,如何控制类菌体的需氧条件,这个要借助于专化的豆红血蛋白(leghemoglobin)、细胞色素和分支的呼吸代谢途径来调节。豆红血蛋白与动物肌红蛋白有结构与功能上的相似性,两者都有结合氧的特性。豆血红蛋白的进氧扩散,以致被结合的“氧流”超过游离的溶解氧的104~105倍。所以,即便在类菌体周围氧“浓度”低,但经过血红蛋白的释放又会保证维持氧的恒定,用于产生ATP的氧立即被置换出来。
氧浓度对类菌体内的呼吸链电子传递体的调节,如通过不同亲和力的氧化酶或细胞色素的氧载体,呈现多种适应性是可能的。在好气性自生固氮菌中,既需氧生长又要使氧与固氮酶分隔开,这就要学会有氧生活。对此,人们已提出一种可能的氧分压(PO2)对呼吸代谢途径产生ATP、还原物质与固氮关系的复杂机制的看法,也有提出非豆科植物根瘤没有血红朊,酪氨酶可能作为氧的载体,但仍不知如何控制供氧的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




