一、固氮酶的特性
1.酶的特性
20世纪50年代人们利用同位素15 N来测定生物固氮的活性,有利于对固氮酶提取成分的跟踪。1960年,Canahan等在巴氏芽孢梭菌的一种提取液中肯定地证明固氮活性,随之在许多自生菌和豆科根瘤菌的研究中报道无细胞制备剂的固氮能力及制备方法,从而展开了固氮酶的系统研究。固氮酶在常规条件下提取分离很易失活,所以,它需要在无氧条件下提取分离,还要加入丙酮酸作为电子供体和一个能量(ATP+Mg2+)才能表现出固氮能力。当研究者在了解这种情况后,很快从各种生物中得到纯化的固氮酶。
固氮酶包括两个组成部分:组分Ⅰ含有钼(Mo)和铁(Fe)称钼铁蛋白;组分Ⅱ只有铁亦称铁蛋白。两者都对O2敏感。当两者分开时固氮酶不具活性,只有合在一起才表现固氮活性。
2.固氮酶的结构与功能
固氮酶的MoFe蛋白和Fe蛋白的分子结构直到20世纪90年代才得到解析,其中,对棕色固氮菌(Azotobacter uinelandii)、巴氏梭菌(Clogtridum pateuranum)和克氏肺炎球菌(Klebsiella pneumoniae)的研究比较深入。这里以棕色固氮菌为例加以说明。
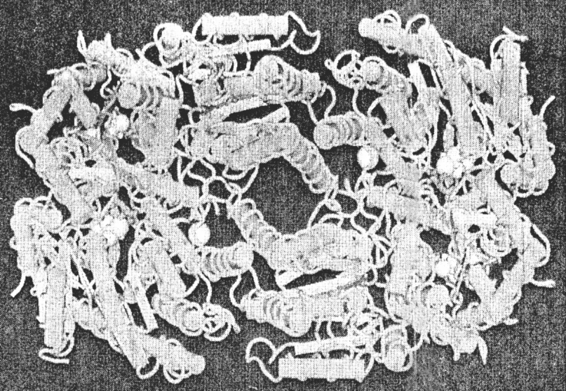
MoFe蛋白,由2个αβ二聚体非对称组成四聚体(α2β2),如图5-1所示。α亚基和β亚基的分子量分别为60KD和55KD,MoFe蛋白总分子量为230KD。α亚基和β亚基多肽链的折叠方式相似,都是由3个α/β结构域和一些单独的α-螺旋组成。在α亚基中含有一个MoFe7S9金属原子簇。其MO端分别与一分子高柠檬酸的一个羟基氧和一个羟基氧共价连接,共同组成酶的活性中心,称为铁钼辅因子(FeMo-Co),它是底物(N2、H+、C2H2)结合与还原的部位。Mo端还与α多肽链的442位组氨酸(Hisα442)残基共价结合,其Fe端与273位半胱氨酸(Cysα273)共价结合,从而将FeMo-co固定在α亚基中。再在αβ二聚体的交界处结合着另一个由Fe8S7组成的金属原子簇,称为P一簇。它是一种电子递体,接受由Fe蛋白传来的电子,再传递给FeMo-co用于还原底物,起着氧化还原的作用。
 (https://www.xing528.com)
(https://www.xing528.com)
图5-1 棕色固氮苗MoFe蛋白(а2β2)三维结构
Fe蛋白,由2个相同的γ亚单位组成轴对称的γ2二聚体,如图5-2所示。每个亚基都是一个大的α/β结构域,由8个平等β折叠片和9个α-螺旋组成,α-螺旋包围着β-折叠片核心。在两个亚单位交界处埋藏着一个Fe4S4原子簇,还各有一个结合MgATP的位点。Fe4S4也是一个电子传递体,其供体是缺氧还蛋白(fd)。当Fe蛋白与MoFe蛋白结合时,ATP水解成ADP+Pi,释放出能量,引起氧化还原电位下降和固氮酶结构发生改变,有利于电子和质子传递给MoFe蛋白中P一簇。
αβγ2可看作固氮酶复合体的一个基本功能单位,也就是每个αβ功能单位的顶端各结合一个γ2二聚体。其实,在体内真正有功能的固氮酶是由α2β2γ46个亚基组成的呈斜轴非对称的复合体。
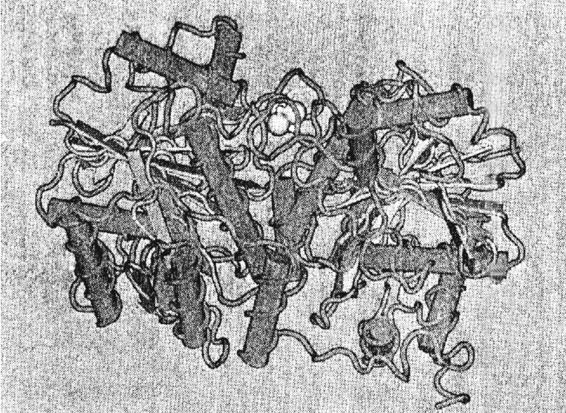
图5-2 棕色固氮菌Fe蛋白(γ2)三维结构
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




