一、花药与花粉的培养
花药与花粉的培养指在合成培养基上,改变花粉的发育途径,使其不形成配子,而像体细胞一样进行分裂、分化,最终发育成完整植株。花药是植物花的雄性器官,包括体细胞性质的药壁和药隔组织,以及雄性性细胞的花粉粒。按染色体的倍性来看,前者为二倍体细胞,后者为单倍体细胞。因此,从组织器官的角度来讲,花药培养属于器官培养的范畴,但其培养目的并不是诱导其药壁和药隔组织得到二倍体植株,而是诱导其中的花粉细胞以获得单倍体植株。花粉培养属细胞培养的范畴。花药培养和花粉培养的目的一样,都是要诱导花粉细胞发育成单倍体细胞,最后发育成单倍体植株。
花药与花粉培养的意义在于花粉植株作为单倍体植株,其表现型和基因型一致,一旦发生显性或隐性突变,在当代即能表现出来,提高了目标基因型的选择效率,因而是体细胞遗传研究和突变育种的理想材料;通过F1代花药或花粉培养得到单倍体植株后,经过染色体加倍即成为纯合二倍体,可以显著缩短杂交育种周期,加快育种进程。另外,花粉植株还是进行物种进化研究、构建作物遗传图谱等的理想材料。
(一)花药培养
花药培养是指应用组织培养技术,将花粉发育至一定阶段的花药接种到人工培养基上,以诱导花粉粒改变其发育进程,形成花粉胚或花粉愈伤组织,进而分化成苗的技术。这是目前获得单倍体植株的主要方法,如图4-8所示。
1.了解小孢子的发育过程
在植物体中,花粉母细胞经过减数分裂形成四分孢子,经过单核期、二核期和三核期最终发育成成熟花粉,这个途径称为花粉配子体发育途径(见图4-9)。而在离体培养条件下,花粉的第一次有丝分裂在本质上与合子的第一次孢子体分裂相似,脱离配子体发育途径,最终发育成植株,这种花粉形成植株的途径称为花粉孢子体发育途径。目前多数学者把花粉沿孢子体途径发育成花粉植株的过程称为雄核发育。
2.确定花粉发育时期
在花药培养的过程中,并非任何时期的花粉都可以诱导出花粉植株,只有花粉发育到特定的时期,才对处理和离体培养敏感。所以,选择适宜的花粉发育时期是提高花粉植株诱导成功的重要环节。尽管雄核发育可在四分体时期和双核期被诱导,但大多数植物适宜花药培养的时期为单核期,尤其是单核中、晚期(见表4-2)。因此在采集花蕾时需要确定它处于何时期是花药培养的关键技术。
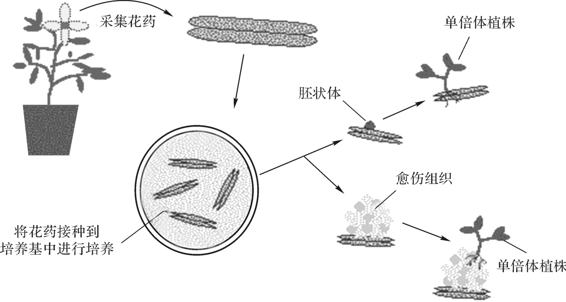
图4-8 花药的培养过程

图4-9 小孢子发育过程图解(王蒂,2004)
1.四分孢子 2.单核早期 3.单核中期 4.单核晚期 5.第一次有丝分裂中期
6.双核初期 7.双核中期 8.双核晚期 9.三核期 10.成熟
表4-2 不同植物花药培养适宜的花粉发育时期
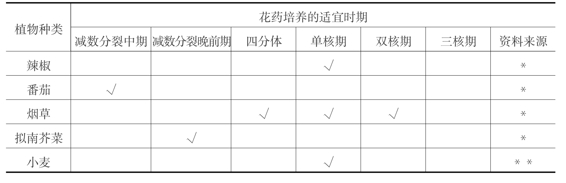
续表

资料来源:*引自中科院北京植物所和黑龙江省农科院,1977;**引自卫志民,1999;***引自傅润民,1994。
确定花粉发育时期最简捷有效的方法是压片镜检法。水稻和玉米采用I-KI染色效果比醋酸洋红更好,而对于DNA含量较低的材料,最好用孚尔根试剂染色。通过镜检确定花粉的发育时期,并找出花粉发育时期与花蕾或幼穗的大小、颜色等形态学性状的相关性,以便于直接快速而准确地选取到适宜的花蕾而无需作镜检,从而极大地提高花药培养的工作效率。如烟草的花萼与花冠等长时的花蕾,其花粉发育时期就处于单核后期;小麦的叶耳间隔长5~15cm,幼穗中的花粉处于单核后期。但是,花药的这种外部形态与花粉发育时期的相关关系,不是固定不变的,会因品种及种植环境条件的不同而发生改变。因此,在实践中要做到外部形态观察与压片镜检相结合。这需要长期实践才能积累的经验。
3.花药的预处理
在接种前后对花药采取适当的方法进行预处理,可以显著提高花粉的存活和绿苗产量。
(1)高低温处理
高低温处理包括低温预处理、低温后处理以及热激处理。前者是在接种前将材料置于0℃以上低温处理一段时间后再接种;后者则是指花药接种后,先在较高温度下(一般为30℃~35℃)培养数天,然后再移至正常温度下继续培养;低温后处理是指花药接种后,先在低温环境中培养一段时间,再移至正常温度下继续培养。研究表明,在多数植物的花药培养中采用上述预处理方法,均可在不同程度上提高花粉愈伤组织或花粉胚状体的诱导率和花粉植株的再生频率。
(2)药剂处理
常用的药剂有秋水仙素、乙烯利、甘露醇、高糖等。添加0.05%~0.1%秋水仙素的作用主要是使小孢子发生均等分裂;100mg·L-1乙烯利喷施烟草植株的花芽,再取其花药培养,其雄核发育提高了25%;甘露醇预处理能明显地提高花粉存活率,使发育进度比低温预处理和对照提早2~3h;接种前用高糖预处理花药一定时间,再转移到适宜的糖浓度下培养,可以大幅度提高愈伤组织和胚状体的诱导率。
(3)其他处理
据报道,γ射线对小孢子也有刺激作用,其辐射处理可诱导花粉愈伤组织形成,而γ射线和低温处理结合效果更好。离心处理也是有效的预处理方法。如烟草花蕾在花药取出前在5℃、冷冻离心机500rpm的转速下离心1h,可明显提高单倍体植株的诱导率。另有报道,磁场处理单核期的花蕾也有明显效果。
4.花药培养的方法
花药培养方法参见实验实训4-3和本节“影响花药培养的因素”的内容。
5.评价花药培养质量的几个技术指标
在通过花药培养获得单倍体植株的培养过程中,通常根据以下几个指标对花药培养体系进行科学的量化评价。
(1)污染率与褐化率
花药接种后,每隔3~5d观察记录一次污染的花药数,直到结果不再变化为止,统计污染率和褐化率(计算褐化率时不包括污染的花药数目)。污染率和褐化率的计算公式如下:

(2)出愈率
在花药培养中,多数情况下花粉植株是通过愈伤组织方式产生的。愈伤组织诱导率(或称出愈率)的计算公式如下:

(3)胚诱导率
在花药接种60d左右,统计接种的花药数和出胚数(不包括污染和褐化的花药数),计算诱导率。花粉胚的诱导率的计算公式如下:

(4)绿苗分化率
大部分禾谷类作物在花药和花粉培养过程中,会出现部分形态没有明显异常,但缺乏绿色的植株,即白化苗的现象。白化苗缺乏叶绿素,没有完好的叶绿体,在异养条件下只能生长一段时间,很难开花结实,没有利用价值。有时白化苗的比例可高达80%以上,给花粉植株的诱导造成严重的影响。绿苗分化率计算公式如下:
 (https://www.xing528.com)
(https://www.xing528.com)
6.影响花药培养的因素
(1)基因型
植物基因型是影响雄核发育的最重要的因素之一。同一物种中的不同基因型对小孢子离体诱导反应差异较大(见表4-3)。再如在水稻中,籼稻花粉培养力远低于糯稻。
表4-3 芸薹属植物Brassica napus不同基因型的小孢子产胚率比较

(2)花粉发育时期
多数植物在单核期(第一次有丝分裂前)对诱导反应最敏感,为最佳培养期。形成双核后,在合适的条件,主要由营养细胞分裂产生胚状体。王玉英等学者比较了辣椒和甜椒的花粉处于单核早期、单核靠边期、双核期的花药培养效果,指出单核靠边期效果最佳。
(3)预处理
接种前后采用适当的方法对花药进行预处理是目前可以显著地提高花药培养的成功率,使绿苗产量大大增加的有效措施。低温处理时间根据培养温度而定,较低的温度处理时间短,较高的温度处理时间长。如典型的玉米花药的处理时间为4~8℃下处理7~14d,马铃薯花药在4℃下处理2d。
(4)培养基
基本培养基是花药培养中影响花粉启动和再分化的重要条件,应根据植物的种类不同,选用适宜的基本培养基。MS及Nitsch培养基广泛用于双子叶植物的花药培养;B5培养基广泛用于十字花科及豆科植物的花药培养。为了提高水稻、小麦花药的诱导频率,我国科学工作者研制出N6培养基,随后又研制出C17和W14培养基,它们均可极大地提高水稻等禾本科的花药出愈率。黄玉英等在辣椒花药培养中试用了MS、N6、NTH等培养基,结果发现在N6上只形成愈伤组织,而没有胚状体,在MS、NTH上都形成了愈伤组织和胚状体,但NTH培养基上形成胚状体的频率较高。
碳源种类与浓度对花药培养的效果是不同的。培养基中的糖在花药培养中起到提供碳源和调节渗透压的作用。Butter等比较了8种糖,得出蔗糖对花药培养效果最好。另外,不同的糖浓度与花药培养效率也有密切关系,王玉英等对不同浓度蔗糖进行了对比,发现培养10d后,12%的浓度中活花粉和已分裂花粉的数量较多,20d后,较高浓度的培养基中(9%,12%)花粉大量死亡,而在低蔗糖浓度(3%,6%)中,已分裂的花粉能继续发育成胚,且6%的蔗糖浓度最佳。
生长素和细胞分裂素的各类和适当比例,能促进孢子体的小孢子发育。王玉英等研究指出,低浓度的2,4-D对辣椒花药培养的效果不佳,而只有在低浓度NAA、IAA的条件下,才有利于胚状体的形成;培养基中附加0.5mg·L-1的KT、1mg·L-1的6-BA能够提高花药的出胚率。
Butter等通过比较不同的培养基固化材料,发现0.1%~0.2%脱乙酰基吉兰糖胶固化培养基与琼脂固化培养基相比,胚状体的产量多1倍。
(5)培养条件
一般认为,花药培养在诱导愈伤组织和胚胎期间进行暗培养或给以散射光处理较好。强光虽然有利于以后的绿苗分化,但会抑制愈伤组织的产生,而散射光既不影响愈伤组织的形成,也有利于以后的绿苗分化。连续光照可增加烟草花粉胚的形成,却抑制曼陀罗花粉胚的发生。
变温处理是离体花药诱导花粉发育成功的关键因素。多数植物在25℃条件下,可完成愈伤组织的诱导过程。此外,无论是冷处理还是热处理,都能使胚状体和再生植株的数量大大增加。如Dumas在甜椒的花药培养中采用35℃的高温诱导,然后在25℃条件下培养,能大幅度提高花粉胚的诱导率。
培养时的温度和光照对辣椒花药培养的效果起重要作用,早期的研究工作多在24~30℃的恒温条件下进行培养,而现在多采用变温处理。Roman采用4℃低温诱导后,28℃持续培养,一般在进行35℃高温培养的8d中采用的是暗培养,再转入25~28℃的培养条件,其光照强度为1500~2000lx,光照时间为10~12h。光质对植株再生有不同的影响,往往光合的作用光谱对再生作用最有效,在实验室培养过程中最常用的是白色荧光。
(6)接种密度
接种密度与诱导率成正相关,这就是所谓的花药或花粉培养的“群体效应”。李春玲(2001)发现提高花药的接种密度,能明显提高甜椒的胚诱导率。其研究结果表明,在50m l的三角瓶中接种10个花蕾,其胚状体的诱导频率最高,但是接种密度提高的同时必须加快接种速度,否则污染率会升高。
(二)花粉培养
1.花粉培养的含义
花粉培养是指将发育到一定阶段的花粉从花药中分离出来,成为分散或游离状态进行培养,从而改变其正常的配子发育进程,而像正常体细胞一样进行脱分化形成愈伤组织或胚状体,再分化为单倍体植株的技术。离体培养的花粉分化成苗的途径与花药培养相同,也具有胚状体和愈伤组织两种再生途径。
2.花粉培养的工艺流程
花粉培养的工艺流程如下:确定花粉发育所处的时期→采集适宜培养的花蕾→3~5℃冷藏约5d→流水冲洗3min→转到超净工作台内→70%酒精消毒30s→0.2%升汞消毒10min→无菌水漂洗6次(第1次30s,后5次各1min)→花粉分离(见图4-10)→离心纯化→接种(要求接种密集一些)→培养(25~28℃,光强300~500lx,光照时间8~10h·d-1),约20~30d,出现愈伤组织或花粉胚→转接到分化培养基中进行分化培养→形成花粉植株(为单倍体)。

图4-10 花粉挤压分离法(引自竹内正幸等,1996)
3.花粉培养的方法
(1)浅层静止培养
浅层静止培养是指将上述分离得到的纯化花粉,调整到一定的密度,置于培养皿或特制的扁瓶中静止培养。培养液的厚度以能盖过培养皿或扁瓶底部为宜(宝5cm的培养皿,放2.5ml培养液),不使花粉粒没入培养基太深,待愈伤组织或胚状体形成后,转入分化或胚发育培养基上生长。其优点是培养物与空气接触面积大,通气好,细胞的代谢产物也易于扩散,避免有害物质的局部累积而对培养物产生毒害。另外,方便添加新鲜培养液或转移培养物,也便于观察和照相。缺点是易造成悬浮在细胞培养液中的游离细胞局部密度过高或过低,有时也会出现密集的细胞在某一区域连成一片的现象,影响细胞的分裂。
(2)平板培养
平板培养即花粉置于薄层琼脂培养基上进行培养(见图4-11),具体方法与单细胞培养相同。它的优点是花粉细胞在培养基中分布均匀,不会连成片,并便于连续观察花粉细胞的发育情况。缺点恰恰是液体浅层静止培养的优点。因此,游离细胞往往发育速度较慢。
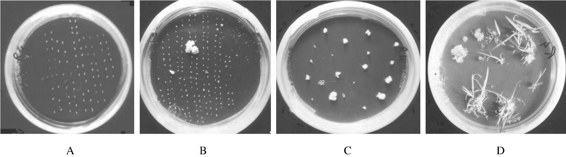
图4-11 A为接种在平板上的水稻花药,B为部分花药产生愈伤组织,
C为愈伤组织转接种到再生培养基,D为愈伤组织分化形成再生植株
(3)看护培养
图4-12是Kameya和hinate等成功建立的看护培养体系。具体做法是将完整花药或来源于花器官的愈伤组织接种在琼脂培养基上,在花药或愈伤组织的上面垫一片圆形无菌滤纸片,然后将花粉粒放在滤纸片上进行培养。Sharp(1972)将番茄花粉看护培养1个月后,在滤纸上形成细胞群落,植板效率可达60%,而将花粉粒直接接种在琼脂培养基上,则不能生长。据报道,培养的花药提取物同样对花粉粒产生同样的培养效率。因此,看护培养也可改为条件培养。具体做法是先将花药在培养基中进行短期(如1周)培养,然后取出花药浸泡在沸水中杀死细胞,经研磨、离心,上清液即为花药提取物,经过滤灭菌后加到培养基中,再接种花粉进行培养。这种条件培养容易培养成功。
(4)微室培养
操作方法与细胞培养相同。Kameya等(1970)用此法培养甘蓝×芥蓝F1的成熟花粉获得成功。具体做法是先把F1的花序取下,表面消毒后用塑料薄膜包好,放置1夜后花药开裂,花粉散落,制成每滴含50~80个花粉的悬浮培养基,进行悬滴培养。
4.花药培养与花粉培养的区别
花药培养和花粉培养的主要目的都是获得单倍体植株,但二者有明显的区别,表现在以下三方面:①在培养的材料性质上,花药培养属于器官培养,而花粉培养为单细胞培养。②在培养方法上,花药培养多为固体培养;花粉培养采用单细胞培养的方法,如平板培养、看护培养、微室培养等。③在培养的难易程度上,花药培养相对于花粉培养来说,技术要求简单,容易成活,出胚(愈)率高。
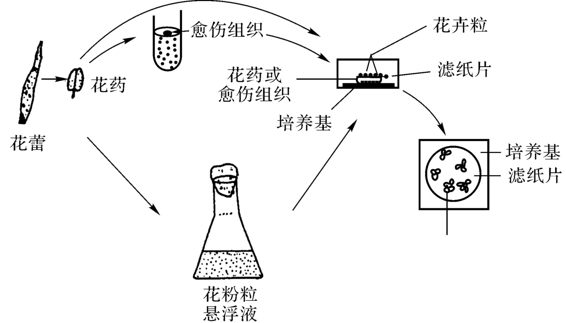
图4-12 游离花粉粒的看护培养技术
另外,从遗传特性而言,由于同一个花药内的花粉存在异质性,因此由一个花药所产生的植株将是一个异质的群体,而且如果花粉植株是经过愈伤组织途径产生的,容易发生嵌合现象。在花药培养过程中,药壁和药隔等体细胞组织也有可能发育,存在花药壁、花丝、药隔等体细胞组织的干扰,导致部分植株为体细胞起源。而花粉培养一般不存在上述问题。
5.花粉植株的驯化移栽要求
花粉植株较常规快繁的试管苗要娇嫩,对外界的适应性很差,因此移苗时必须特别仔细。移栽时期最好避开盛夏季节,否则可将试管苗冷藏在约4℃的培养箱中,待至合适移栽时再取出,在自然光下炼苗5~7d后移栽到温室。花粉植株移栽后要求保持较高的空气湿度(80%~90%,1~2周)和较低的土壤湿度;温度保持16℃~20℃,温度过高过低都会影响移栽的成活率;要求良好光照条件。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




