二、茎的培养
茎尖是植物组织培养常用的外植体。这是因为茎尖不仅生长速度快,繁殖率高,不易产生遗传变异,而且是目前获得脱病毒苗木的最有效途径。茎尖培养根据培养目的和取材大小分为微茎尖培养和普通茎尖培养。前者主要用于脱毒苗的培养,后者主要用于营养器官的快速繁殖。微茎尖是指带有1~2个叶原基的生长锥,其长度一般不超过0.5mm(见图4-2)(大小因植物各类和芽部位的不同而有所差异),主要用于脱除植物体内病毒(具体内容见模块6);普通茎尖是指较大的茎尖(几毫米到几十毫米)、芽尖及侧芽,培养技术简单易行,操作方便,容易成活,成苗所需时间短,常用于植物的离体快速繁殖。而带有1个以上定芽或不定芽的茎段(包括块茎、球茎、鳞茎的幼茎切段)培养除具有普通茎尖培养的特点外,还具有材料来源广泛、“芽生芽”方式增殖的苗木变异小和性状均一的特点,它往往与微茎尖培养技术配合使用,即通过微茎尖培养获得了脱毒苗,再将脱毒苗通过普通茎尖培养进行快速繁殖。由于茎尖和茎段等是在无菌条件下,且又是在一个非常小的范围内进行大量繁殖,因此又称为微繁技术。
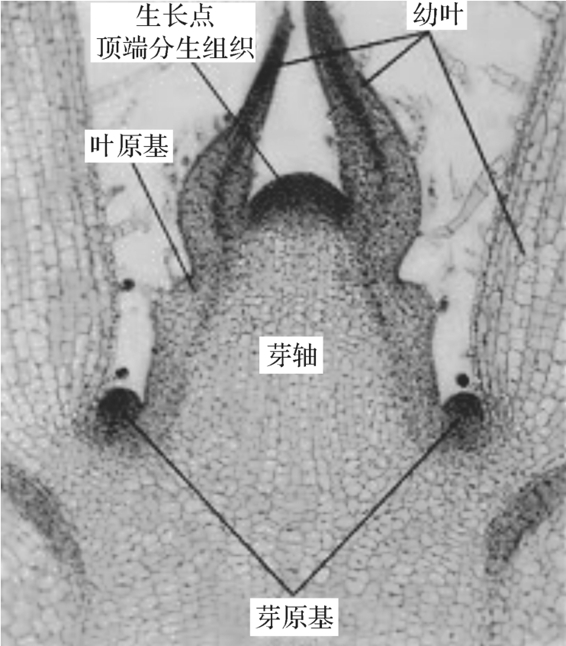
图4-2 茎尖纵剖面
(一)普通茎尖培养
1.培养基的选择与准备
不同植物茎尖的培养,所用的培养基是不同的。一般应通过查阅资料和请教行家或自己做一些试验工作后,筛选出适宜的培养基。多数茎尖培养以MS作为基本培养基或略加修改,或补加其他物质。据朱至清报道,大量元素含量减半,不加肌醇,并将VB1提高到1mg·L-1的改良培养基,适合于大多数单子叶和双子叶植物。木本植物的茎尖培养也可选用WPM培养基。另外在培养基中添加生长素是必需的,因为它们能有效地促进芽的生长发育,但是浓度不能太高,一般用0.1mg·L-1左右,高于此浓度,往往产生畸变芽或形成愈伤组织。但不同种类植物对生长素的反应是不同的,所以应区别对待,灵活运用。茎尖培养一般选用固体培养基,而对于易发生褐化的可以考虑采用液体培养基,以便减少培养物周围酚类化合物的积累和及时将培养物从褐化的培养基中转移到新鲜的培养基中去。培养基的pH值影响茎尖对营养液的吸收和生长速度,对大多数植物的茎尖培养来说,pH值应控制在5.8~6.0之间。
继代增殖所用的基本培养基与初代培养基本相同,有时为了提高繁殖系数,可以适当提高细胞分裂素的比例。促进腋芽增殖最有效的细胞分裂素是6-BA,其次是KT和ZT,使用浓度在0.1~10mg·L-1之间,一般使用0.5~2mg·L-1。有时培养基中也添加低浓度的GA,促进芽的伸长,但浓度太高会产生不利的影响。试管苗生根培养对基本培养基的种类要求不严,如MS、B5、White等培养基都可用于诱导生根。一般从促进植物生根的因素考虑选用低浓度无机盐的基本培养基,如White培养基,像MS、B5培养基因富含N、P、K等元素,能够抑制根的发生。因此,应将这类培养基的无机盐浓度稀释至1/2、1/3甚至1/4。蔗糖浓度降低至1%~1.5%,甚至为0.5%,以增强组培苗的自养能力,使根系发育更加健壮。此外,向培养基中添加适量的生长素,NAA的浓度一般在0.1~10mg·L-1,IBA和IAA可略高些,可明显提高试管苗的生根率。
一旦确定了培养基的配方,接着就开始配制培养基了,具体操作见模块2的相应部分。培养基配制完成后,就可对培养基及无菌操作中用到的器材和无菌水等进行灭菌了,具体操作见模块3的相应部分。
2.外植体的采集与处理
选择晴天从生长旺盛、健壮、无病的供试植株的茎、藤或匍匐枝上切取适当长度的嫩梢,除去嫩梢大叶,因植物种类及材料来源不同,采取不同的消毒方法。材料消毒方法参见模块3中的外植体。
3.无菌操作
与根无菌操作大同小异,具体见实验实训4-2离体茎的培养。为了降低污染,可在无菌接种前再剥掉一些芽鳞片和幼叶,使茎尖约为0.5cm大小,可带3~6个叶原基或更多,以方便操作和省工。一般每瓶接种1个茎尖,以免发生交叉感染(即原来未污染的外植体因接触有菌的物体而最终导致被污染的现象)。
4.培养
接种完成后,将培养瓶转入培养室的培养架上。培养室中的温度控制在25℃左右,因植物而异可作适当调整,或给予适当的昼夜温差等处理。大多数植物的茎尖培养需在光下培养,光照强度在1000~3000lx,光照16h·d-1或24h连续光照,有利于茎尖培养和芽的分化与增殖,但在进行块茎类植物(如马铃薯和花叶芋)和鳞茎类植物(如百合)的芽培养时,如果目的在于诱导小块茎或小鳞茎(珠芽)的分化和增殖,则需要暗培养。增强光照有利于试管苗生根,且对于试管苗移栽有良好的作用,但强光直接照射根部,会抑制根的生长。所以,在生根培养时最好在培养基中加0.1%~0.3%活性炭,以促进生根。由于生长点培养时间较长,琼脂培养基易于干燥,这可以通过定期转移和包口封严等方法加以解决。
茎尖培养的具体过程可大致分为以下几个阶段:
(1)初代培养
茎尖的初代培养属于无菌短枝发生型。外植体启动的关键是培养基中的激素种类、浓度及比例。一般提高细胞分裂素/生长素的比例,以解除顶端优势,促进丛生芽的产生,如图4-3所示。一般顶芽和腋芽培养30~40d左右可长成新梢,但兰科植物多会在茎尖基部产生原球茎。
(2)继代培养
经过约30~40d培养,茎尖长成新梢,这时对它进行“微型扦插”以扩大中间繁殖体。当中间繁殖体的数量达到一定时,就要进行分流,即留一部分生长健壮的苗进行继代增殖,大部分中间繁殖体接种到生根培养基中进行生根,以形成完整的试管苗,如图4-4所示。兰科植物则通过切割原球茎进行继代增殖。
(3)诱导生根
将切下的新梢接种到生根培养基可诱导生根,如图4-3和图4-4所示。一般多采用1/2~1/4MS培养基,并添加适量的生长素类如NAA、IBA等。也可将切下的新梢基部浸入200~500mg·L-1的NAA或IBA溶液中处理1~3min,视根木质化程度而定,然后转移到无激素的生根培养基中。注意更高浓度的生长素对生根有抑制作用。
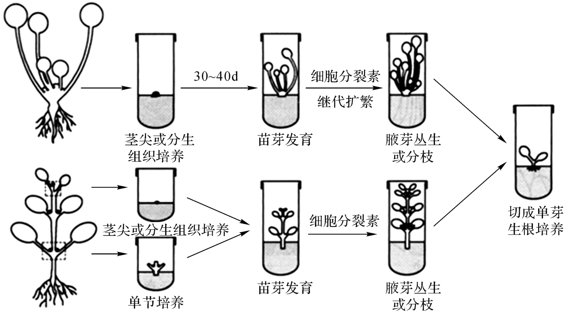
图4-3 丛生芽微繁(引自Pierik,1989)
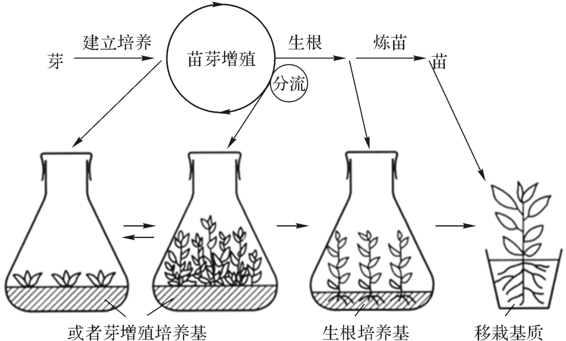
图4-4 腋芽丛生法(引自刘进平,2005)
(4)驯化移栽
在生根培养基中培养1个月左右,多数新梢即可长出健壮而发达的根系。当新梢基部生有5条以上不定根,且根长1cm左右时就可驯化移栽。驯化移栽方法见模块7中的相关内容。
(二)微茎尖培养
微茎尖培养见模块6中的相应内容。
(三)茎段培养(https://www.xing528.com)
1.培养基的选择与准备
培养基的选择与准备具体步骤如下:通过查阅资料或请教有经验的组培行家,并设计试验来确定合适的培养基→按照配方配制培养基→灭菌(包括培养基、无菌水、接种器材等)。
2.外植体的采集与处理
当待培养植物处于生长期,挑选晴天下午采集生长健壮无病虫危害的顶部枝条或中部幼嫩枝条,如果是木本植物则取当年生嫩枝或一年生枝条,带回实验室后去掉叶片,再剪成3~4cm的小段,每段至少含有1个节,如图4-5所示。材料消毒的一般程序同普通茎尖培养。如果枝条表面有厚的角质层、蜡质或绒毛应在消毒剂中滴加1~2滴吐温,以便消毒剂充分地与枝条表面接触,提高消毒效果。注意根据材料的老嫩和蜡质的厚薄来确定消毒剂的种类、浓度和消毒时间。最后用无菌水冲洗3~5次,以彻底去除材料表面残留的消毒剂,以免影响外植体细胞的正常生长。

图4-5 外植体的修剪大小
3.无菌操作
切除已经消毒好的茎段两端,因两端常被消毒剂损害。分切成单芽小段竖插于诱导培养基中。在切割时,靠近节下端的要斜切,以增加与培养基的吸收面积,上端则平切,以减少水分蒸发的面积。
4.培养
要求培养室的温度在25℃,光照强度为2000~3000lx,每天光照时间为12~14h,相对湿度为80%~90%。
初代培养约3~5d,茎段切口处特别是基部切口处有时会形成少量愈伤组织,但主要是腋芽开始向上伸长,形成新茎梢,有时会出现丛生芽。再培养约2周,则会长出较多的新梢或丛生芽。这时就可进行继代扩大繁殖了。继代培养的途径主要有:促进腋芽的快速生长与诱导形成大量不定芽,前者的优点是不会产生变异,方法简便,每年从一个芽可增殖10万株以上;后者的缺点会产生变异。继代增殖过程注意选用适宜的培养基和生长调节剂。
生根培养的目的是使再生的大量试管苗形成根系,获得完整的植株,以便驯化移栽和早日移植到大田或出售。培养基可选择:1/2、1/3或1/4的MS、B5或White培养基,另外附加生长素(NAA浓度为0.1~1.0mg·L-1,IBA和IAA可稍高)以降低或除去细胞分裂素。此外,添加0.3%活性炭也可促进生根。
(四)影响茎尖和茎段培养的主要因素
1.植物类型
由于不同的植物种类,其形态、结构、生理及生态习性不同,因此,培养它们时有针对性地选择好适宜的培养基和培养条件是非常重要的。
2.取材部位
对于草本植物而言,外植体应取幼嫩、健壮的部分;对于草花,应选择以生长健壮、生长势旺的枝体为宜,如图4-6所示。在幼树上采集外植体,以健壮的丁梢枝或侧枝为宜,如图4-7所示。对于从成年大树上取外植体,不取外围的枝叶,而取内堂枝条,因为内堂枝条往往含有较高的促生长激素。另外,由于顶芽的数量有限,因此经常使用侧芽(带侧芽的茎段)做外植体。所以,芽的着生部位对茎尖培养的影响不能一概而论。此外,从取材植株的年龄来说,从幼年树木取材培养较成年树木容易,一年生或多年生草本植物的营养生长早期取材培养较营养生长后期容易。

图4-6 草本植物外植体的选取

图4-7 左为草本植物外植体的选取,右为幼树外植体的选取
3.取材时间与芽的生理状态
取材的时间最好选择在植株的萌动期或活跃生长期,否则就需采用某种适当的措施,例如向培养基中添加GA3等措施以打破休眠,促进芽的生长发育。温带木本植物的萌芽多数只限于春季,故茎尖和茎段培养最好在春季进行,此时芽已充分做好萌发前的准备,叶芽饱满,代谢活动蓄势待发,加上芽鳞片未开展,成活率较高。而且此时取材方便消毒处理,可减轻因消毒剂对生长锥细胞的伤害。
对处于休眠期的块茎、鳞茎、球茎等进行茎段培养,则必须经过高温、低温处理或特殊光周期处理之后再进行,如水仙鳞茎在培养之前需在1~4℃下放里2~4周。
4.外植体大小
在最适培养条件下,外植体的大小决定茎尖的存活率,外植体越大,产生再生植株的机会也就越多,但培养的茎尖材料过大,也会不利于丛生芽与不定芽的形成,容易受到污染;外植体越小脱毒效果越好,但越难成活。除了外植体的大小之外,叶原基的存在与否也影响分生组织形成植株的能力,一般认为,叶原基能向分生组织提供生长和分化所必需的生长素和细胞分裂素。在含有必要的生长调节物质的培养基中,离体顶端分生组织能在组织重建过程中迅速形成双极性两端。另外,生长健壮而饱满的茎尖微繁殖容易成功。
5.培养基和培养条件
在茎尖培养中,光下培养的效果通常比暗培养效果好,如马铃薯茎尖培养时,当茎已长到1cm高时光照强度便可增至4000lx。其他参照普通茎尖培养。
6.极性
极性在不同的植物离体培养中有不同的反应。如将杜鹃茎切段的形态学下端竖插在培养基上,从远离基部的表面上诱导出茎芽的数目较多;而当把唐菖蒲外植体的基部向上放置时,也可以产生茎,但数目较少;水仙花茎切段只有倒放在培养基上才有器官发生。为何会如此,至今还没有统一的说法。注意使用适当的激素后,能削弱或加强极性的影响。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




