二、培养
培养是指在人工控制的环境条件下,使离体材料生长、脱分化形成愈伤组织或进一步分化成再生植株的过程。
(一)培养条件
1.温度
温度不仅影响植物组织培养育苗的生长速度,也影响其分化增殖以及器官建成等发育进程。大多数植物组织培养的最适温度在23~27℃之间。但是不同植物组织培养的最适温度不同,如百合的最适温度是20℃,月季是25~27℃。
2.光照
光照对植物组培的影响主要表现在光照时间、光照强度及光质三个方面,它对细胞增殖、器官分化、光合作用等均有影响。外植体生长发育所需的能源主要由外来碳源提供,光照主要是满足植物形态的建成,300~500lx的光照强度基本可以满足,但对于大多数的植物来说,2000~3000lx比较合适。光周期影响植物的生长,也影响花芽的形成和诱导。一般保证14~16h·d-1的光照时间就能满足大多数植物生长分化的光周期要求。光质对愈伤组织诱导、组织细胞的增殖以及器官的分化都有明显的影响。如百合珠芽在红光下培养8周后,分化出愈伤组织,但在蓝光下只要3周就出现愈伤组织,而唐菖蒲子球块接种15d后,在蓝光下培养首先出现芽,形成的幼苗生长旺盛,而白光下幼苗纤细。
3.湿度
湿度包括培养容器内和环境的湿度条件。容器内湿度主要受培养基的含水量和封口材料的影响。前者又受到琼脂含量的影响。冬季应适当减少琼脂用量,否则,将使培养基变硬,不利于外植体插入培养基和吸水,导致生长发育受阻。另外,封口材料直接影响容器内湿度情况,封闭性较高的封口材料易引起透气性受阻,也会使植物生长发育受影响。
环境的相对湿度可以影响培养基的水分蒸发,一般要求70%~80%的相对湿度,常用加湿器或经常洒水的方法来调节湿度。湿度过低则培养基丧失大量水分,导致培养基各种成分浓度的改变和渗透压的升高,进而影响组织培养的正常进行。而湿度过高则易引起棉塞长霉,导致污染。
4.渗透压
培养基中因存在盐类、蔗糖等化合物,故会影响溶液渗透压的变化。当溶液的渗透压在1~2个大气压时,有利于植物细胞正常生长,2个大气压以上就会造成原生质体失水收缩过度,反之,若溶液渗透压较低时,会引起植株过度吸水,两者均会影响外植体细胞的生长,甚至死亡。
5.pH值
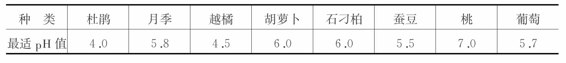
培养基的pH值影响培养物对营养物质的吸收和生长速度。对大多数植物来说,培养基的pH值控制在5.6~6.0之间,但在蝴蝶兰培养时,pH值只能用5.3,否则会影响原球茎的形成和分化;杜鹃的培养基则要求pH值为4.0。pH值过高,不但培养基变硬,阻碍培养物对水分的吸收,而且影响离子的解离释放;pH值过低,则容易导致琼脂水解,培养基不能凝固。
不同植物组织培养对环境的最适pH值的要求是不同的(见表3-3),大多数植物的最适pH值在5.0~6.5之间,一般培养基pH值为5.8就能满足绝大多植物培养的需要。
表3-3 不同植物组织培养的最适pH值
6.培养基的成分
参见模块二中的单元Ⅱ内容。
7.培养方法
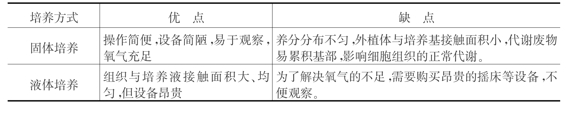
培养方法一般分为有固体培养与液体培养,它们的优缺点如表3-4所示。
表3-4 固体培养和液体培养方法的比较
(二)培养程序
1.初代培养
初代培养是指在组培过程中,最初建立的外植体无菌培养阶段,即无菌接种完成后,外植体在适宜的光、温、气等条件下被诱导成无菌短枝(或称茎梢)、不定芽(丛生芽)、胚状体或原球茎等中间繁殖体的过程。因此,初代培养也称为诱导培养,被诱导形成中间繁殖体均需要无菌。由于外植体的来源复杂,又携带较多杂菌,因此初代培养比较困难。
2.继代培养
通过初代培养所获得的不定芽、无菌茎梢、胚状体或原球茎等无菌材料被称为中间繁殖体。中间繁殖体由于数量有限,需要将它们分割后转移到新的培养基中培养增殖,这个过程称为继代培养。继代培养是继初代培养之后的连续数代的培养过程,旨在扩繁中间繁殖体的数量,最后能达到边繁殖边生根的目的。由于培养物在接近最好的环境条件下生长,又排除了其他生物的竞争,所以中间繁殖体可按几何级数扩繁,例如以2株苗为基础,每棵苗的繁殖系数为3(即1株苗剪成3段接种,培养一段时间后每段又形成3株苗),那么经10代繁殖,将生成2×310=118098株苗。
3.壮苗与生根
(1)诱导生根的一般要求
当丛生芽苗增殖到一定数量后要分离成单苗转入生根培养基进行生根诱导。一般认为矿质元素含量高,有利于茎叶生长,较低时有利于生根。所以生根培养基多采用1/2MS或者1/4MS培养基。另外,培养基要去掉全部细胞分裂素,并加入适量的生长素(NAA、IBA等)。因植物种类不同,一般2~4d即可见根原基发生,当洁白的生长正常的根长约1cm时即可驯化移栽。
温馨提示
1.在丛生芽分化为试管苗时,若遇茎的节间不伸长,可添加适量GA克服,GA还可减少茎基部产生愈伤组织和有助于茎尖成活。
2.保留继代增殖材料的操作原则是挑选最好的中间繁殖体作为继代材料,剩余的在淘汰变异的基础上均可进入生根阶段使之形成完整的试管苗。
3.当中间繁殖体大量增殖后,下一步应该使部分培养物分流到壮苗生根培养阶段。若不能及时将培养物转到生根培养基上去,就会使久不转移的苗发黄老化,或因过分拥挤而使无效苗增多造成抛弃浪费。
4.由一个外植体经整理、洗净及一系列消毒灭菌,接入培养瓶内进行培养,建立无菌培养物,再经若干次扩大增殖与壮苗生根,形成无数且遗传性状相对一致的植物群体的过程称为无性繁殖系。
(2)诱导生根方法
具体步骤包括:①将新梢基部浸入50~100ppm IBA溶液中处理4~8h;②直接移入含有生长素的生根培养基中。上述两种方法均能诱导新梢生根,但前者对新生根的生长发育更为有利,而后者对幼根的生长有抑制作用。其原因是当根原始体形成后较高浓度生长素的继续存在,将不利于幼根的生长发育。不过这种方法比较可行,实践中要选择好适宜的生长素及其浓度。另外也可采用下列方法生根:①延长在增殖培养基中的培养时间;②适当降低增殖倍率,减少细胞分裂素的用量(即将增殖与生根合并为一步);③切割粗壮的嫩枝用生长素溶液浸蘸处理后在营养钵中直接生根。这种方法省去了生根阶段,但只适于一些容易生根的作物。另外,少数植物生根比较困难时,则需要在液体培养基中放置滤纸桥,使其略高于液面,靠滤纸的吸水性供应水和营养,解决生根时氧气不足的问题,从而诱发生根。
(3)生根阶段的壮苗措施
具体步骤包括:①培养基中添加多效唑、比久、矮壮素等一定数量的生长延缓剂;②生根培养阶段将培养基中的糖含量减半,提高光强约为原来的3~6倍,一方面促进生根,促使试管苗的生活方式由异养型向自养型转变;另一方面对水分胁迫和疾病的抗性也会增强。由于胚状体有根原基和芽原基的分化,可不经诱导生根阶段,直接成苗。但因经胚状体途径发育的苗数特别多,并且个体弱小,所以通常需要一个在低浓度或没有植物激素的培养基培养的阶段,以便壮苗生根。由其他途径形成的弱小试管苗也需要经历一个壮苗过程。
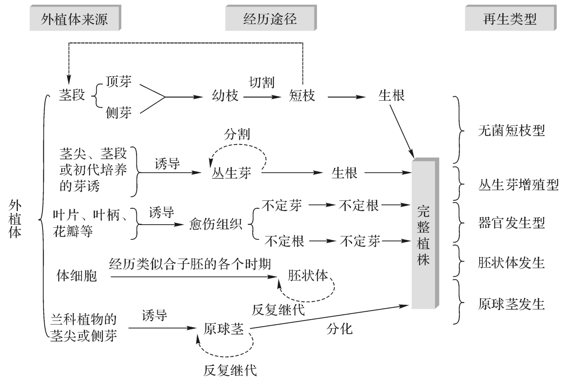
4.植株再生途径
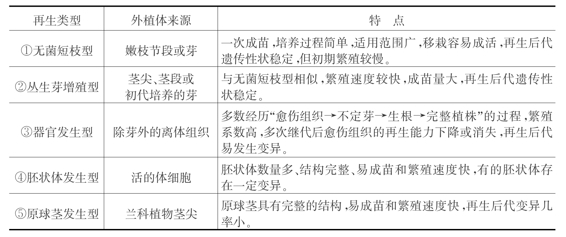
植株再生途径一般可划分为无菌短枝型、器官发生型、丛生芽增殖型、胚状体、原球茎发生型五种类型(见图3-6)。所形成的植株称为再生植株。
 (https://www.xing528.com)
(https://www.xing528.com)
图3-6 植株的再生途径
(1)无菌短枝型
将顶芽、侧芽或带有芽的茎切段接种到培养基上,进行伸长培养,逐渐形成一个微型的多枝多芽的灌木丛状结构。继代时将丛生芽苗反复切段转接,重复芽-苗增殖的培养,从而迅速获得较多嫩茎(在特殊情况下也会生出不定芽,形成芽丛)。这种增殖方式也称为“微型扦插”或“无菌短枝扦插”。将一部分嫩茎切段转移到生根培养基上,即可培养出完整的试管苗。这种方法主要适用顶端优势明显或枝条生长迅速,或对组培苗质量要求较高的一些木本植物和少数草本植物,如月季、枣树、葡萄、矮牵牛、茶花、菊花、香石竹等等。由于其不经过愈伤组织诱导阶段,因此是最能使无性系后代保持原品种特性的一种繁殖方式。实践中应注意芽位的选取,一般以上部3~4节的茎段或顶芽为宜。
(2)丛生芽增殖型
茎尖、带有腋芽的茎段或初代培养的芽,在适宜的培养基上诱导,可使芽不断萌发、生长,形成丛生芽。将丛生芽分割成单芽增殖培养成新的丛生芽,如此重复芽生芽的过程,可实现快速、大量繁殖的目的。将长势强的单个嫩枝进行生根培养,培养成再生植株。
(3)器官发生型
外植体经诱导脱分化形成愈伤组织,再由愈伤组织细胞分化形成不定芽(丛生芽)。这种途径也称为愈伤组织再生途径。有些植物能够直接从外植体表面产生不定芽,如矮牵牛、悬钩子、百合、银杏、柏科和松科的一些植物等。
影响器官发生的主要因素有外植体、培养基和培养环境等。
①外植体。理论上讲所有的植物都有被诱导产生愈伤组织的潜力,但不同植物种类被诱导的难易程度大不相同。一般来说,苔藓、蕨类、裸子植物与被子植物相比,诱导比较困难;在同类植物中,草本植物比木本植物容易;在一种植物中,幼嫩材料较老熟材料易于诱导和分化。通常同一种植物的不同器官或组织所形成的愈伤组织,无论在生理上或形态上,其差别均不大。但是对有些植物而言,确有明显差异。如油菜的花器比叶、根等易于分化成苗;水稻和小麦幼穗的苗分化频率比其他器官高。
开卷有益
愈伤组织形成过程中的特点有:
①分裂期的细胞分裂局限在组织的外缘,主要是单周分裂;在分化期开始后,愈伤组织表层细胞的分裂逐渐减慢,直至停止。愈伤组织内部深处的局部地区的细胞开始分裂,使分裂面的方向改变了,出现了瘤状结构的外表和内部分化。
②迅速生长的愈伤组织,都是极相似的,而当愈伤组织生长速度减慢时,就出现特殊的形状和结构。一个显著的特征是:形成由分生组织组成的瘤状结构,它变成不再进一步分化的生长中心,而在其周缘产生扩展的薄壁细胞。瘤状结构团团地散布在愈伤组织块中。
③出现了各种类型的细胞,如薄壁细胞、分生细胞、管胞、石细胞、纤维细胞、色素细胞等。
④生长旺盛的愈伤组织一般呈奶黄色或白色,有光泽,也有淡绿色或绿色的;老化的愈伤组织多转变为黄色甚至褐色。
②培养基。培养基的类型、组成、激素及其配比、物理性质等,都对愈伤组织诱导和分化不定芽产生一定影响。主要表现以下特点:一是高无机盐浓度对愈伤组织诱导和生长有利,无机盐浓度较高的MS、B5等基本培养基均可用于愈伤组织的诱导。二是生长素与细胞分裂素的浓度和配比是控制愈伤组织生长和分化的决定因素(参见第一章概述中“根芽激素理论”)。通过改变激素的种类和浓度,可有效调节组织的器官的分化。一般高浓度的生长素和低浓度的细胞分裂素有利于愈伤组织的诱导和生长。在生长素类激素中,2,4-D诱导愈伤组织效果最好,但使用浓度过高,则会抑制不定芽的分化;Kt和BA能广泛地诱导芽的形成,而BA比Kt的效力大。三是培养基中添加糖、维生素、肌醇和甘氨酸等有机成分,可以满足愈伤组织的生长和分化的营养要求,糖类物质还起到维持培养基渗透压的作用。四是液体培养基要比固体培养基好,在液体培养基中愈伤组织易于生长和分化。
③培养环境。在离体培养条件下,光对器官的作用是一种诱导反应,而不是提供光合作用的能源,除一些植物愈伤组织培养需要暗环境之外,一般均需一定的光照条件,因为一定的光照对芽苗的形成、根的发生、枝的分化和胚状体的形成有促进作用。对一般植物而言,在25±2℃的恒温条件下都能较好地形成芽和根,而有些植物则需要在一定的昼夜温差下培养。温度高低对器官发生的数量和质量有一定的影响。
(4)胚状体发生型
胚状体类似于合子胚但又有所不同,它也通过球形胚、心形胚、鱼雷形胚和子叶形胚的胚胎发育过程,形成类似胚胎的结构,最终发育成小苗,但它是由体细胞发生的。其中体细胞既可以是成熟的植物根、茎、叶、花等组织细胞,亦可来自花药壁及未成熟幼穗等。这已从伞形科、禾本科等四十余科植物中观察到。胚状体可从愈伤组织形成,亦可不经脱分化直接从子叶、下胚轴和花药培养形成。胚状体可以从愈伤组织表面或悬浮培养的细胞发生,也可从外植体表面已分化的细胞产生。它是植物离体无性繁殖最快的途径,也是人工种子和细胞工程常用的发生途径,但有的胚状体存在一定的变异,应经过试验和检测后才能在生产上大量应用。图3-7与图3-8分别显示胡萝卜和石龙芮胚状体的形成和分化过程。
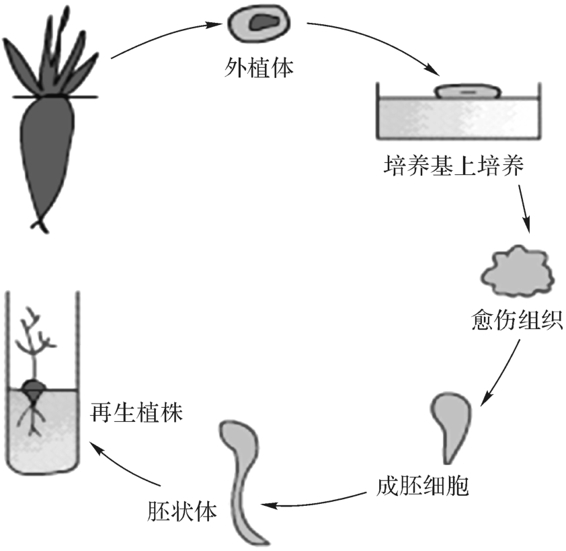
图3-7 胡萝卜胚状体的诱导和分化过程(引自肖尊安,2004)
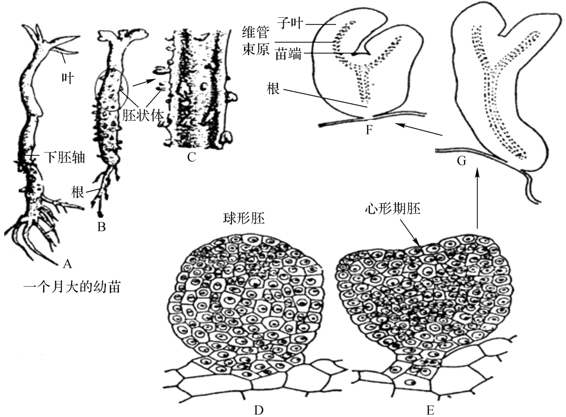
图3-8 石龙芮胚状体的形成(引自利容千等,2004)
开卷有益
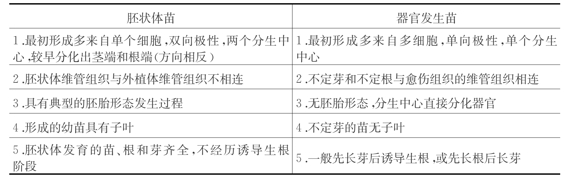
胚状体在组织学上具备以下与不定芽不同的三个特征:
1.最根本的特征是具有两极性,即在发育的早期阶段,胚状体从其方向相反的两端分化出茎端和根端,而不定芽或不定根都为单向极性。
2.胚状体的维管组织与外植体的维管组织无解剖结构上的联系,而不定芽或不定根往往总是与愈伤组织的维管组织相联系。
3.胚状体维管组织的分布是独立的“V”字形,而不定芽的维管组织无此现象。
由于胚状体发生和器官发生均可起源于愈伤组织或者直接来自于外植体,因此这两种再生植株常常容易混淆,表3-5列出了这两种再生植株的主要区别。
表3-5 胚状体苗与器官发生苗的区别
影响胚状体发生的因素主要是培养基中的激素和含氮化合物。
①植物激素。在愈伤组织的产生和增殖过程中,在2,4-D等生长素的作用下,有时会在愈伤组织的若干部位分化形成胚性细胞团,但只有在降低或者完全去除2,4-D等生长素的培养基中(如金鱼草、矮牵牛)才能发育成胚状体。有些植物在只有细胞分裂素的培养基上也能诱导出胚状体(如大麦、檀香);而大多数植物需在生长素与细胞分裂素结合的培养基上才能诱导出胚状体(如山茶、花叶芋)。
②含氮化合物。除生长素外,培养基中还要求有一定量的含氮化合物。对胚状体的形成有作用的是铵根离子。如果愈伤组织是在含有KNO3和NH4Cl培养基上建立起来的,无论分化培养中是否含有NH4Cl,愈伤组织都能形成胚状体。另外,水解酪蛋白、谷氨酰胺和丙氨酸等对胚状体的发生均有一定的作用。
(5)原球茎发生型
原球茎是一种类胚组织,可以看做呈珠粒状短缩的、由胚性细胞组成的类似嫩茎的器官。一些兰科植物的茎尖或侧芽培养可直接诱导产生原球茎,继而分化成植株,也可以通过原球茎切割或针刺损伤手段进行增殖培养。
各种再生类型的特点比较如表3-6所示。
表3-6 各种再生类型的特点比较
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




