第四章 猕猴桃采后生理
果实采后作为活的有机体,体内不断进行着代谢活动,消耗自身的营养物质,直至细胞壁完全破坏、果实软化衰老。果实采后的生命活动和果实的贮藏保鲜效果有着紧密的联系,因此学习果实采后生理活动对指导果实分级、包装、贮藏、运输以及销售等环节,达到降低果实在贮运销过程中的损耗,提高其耐贮性和保持品质的目的有着非常重要的实际意义。
一、猕猴桃果实的软化特征
果实的迅速软化是猕猴桃果实采后最显著的变化之一,采后果实硬度下降速率直接影响贮藏寿命。猕猴桃果实的软化进程可分为明显的两个阶段,即硬度缓慢下降和硬度迅速下降阶段。
果实采后呼吸跃变过程的乙烯大量生成出现在果实软化的第二阶段,其高峰期出现在果实达到可食成熟度之后。即乙烯生成高峰出现时,果实已经完熟,这不同于其他跃变型果实。
陈昆松发现(见图1),猕猴桃果实软化过程的两个阶段因贮藏温度不同,有很大的差异。20℃贮藏果实的两个阶段为前期的硬度缓慢下降和后期的硬度迅速下降阶段;0℃贮藏果实硬度变化则相反,即前期的硬度快速下降阶段和后期的硬度缓慢下降阶段。
猕猴桃果实在贮藏过程中很容易软化,这主要与果实内物质的降解有关。猕猴桃果实在成熟前质地生硬,是因为在初生壁中沉积了许多不溶于水的原果胶以及果心内淀粉粒的累积造成的,所以不可食用。果实成熟后,原果胶在果胶酶的作用下,分解为可溶性果胶、果胶酸酯等,淀粉则在淀粉酶的作用下转化为单糖,使细胞结构受损,果实硬度下降,质地变软。果胶是细胞壁的结构物质,果胶物质降解会引起细胞壁的解体和果实硬度的下降,因此果胶物质组成和含量的变化与果肉硬度有直接的关系。
图1 不同温度处理对早鲜中华猕猴桃果实硬度的影响(引自陈昆松)
二、主要化学成分的变化
随着采后猕猴桃贮藏时间的延长,营养成分作为呼吸基质逐渐被消耗,从而品质发生很大变化。与其他果实不同,猕猴桃果实成熟过程中没有明显的外观颜色变化,采后发生的主要理化变化(见表5)包括可溶性固形物上升,淀粉降解,可溶性糖积累,可滴定酸、VC、草酸和草酸钙含量下降,芳香物质上升等。
周会玲、饶景萍对秦美猕猴桃常温贮藏效果进行了研究,结果表明贮藏30 d,秦美猕猴桃可溶性固形物就增加到11.8%,达到可食状态。VC在整个贮藏期间逐渐减少,贮藏60 d,VC含量降为26 mg/100 g,几乎失去营养价值。糖和酸含量在贮藏后期发生明显变化,总糖含量迅速上升,总酸迅速下降。
表5 猕猴桃果肉硬度和内含物含量在贮藏期的变化(引自周会玲、饶景萍)
梁华弟等人研究发现,酶的分解、物理溶解及暴露空气受热氧化分解是猕猴桃果实VC损失的主要原因。
三、呼吸生理
呼吸作用是猕猴桃采收后生命活动的中心,与猕猴桃产品品质的变化、贮藏寿命、贮藏中的生理病变及猕猴桃的商品处理方法和贮藏保鲜方法都有密切的联系。果实的呼吸类型一般分为两种:一种是跃变型,一种是非跃变型。
根据1979年和1982年的初步研究,证明猕猴桃是一种具有典型呼吸跃变期果实。在后熟过程中有呼吸和乙烯释放高峰,并伴随有果实组分和质地的明显变化。在不同种类、品种间差异较大,跃变峰出现越早,呼吸强度越大,果实软化衰老越快。
与美味猕猴桃相比,中华猕猴桃呼吸跃变期较早,呼吸强度大,在20℃温度下后熟的经1~2周出现呼吸高峰(见图2),呼吸速率从采收时的CO2 40~50 mg/(kg·h),急剧上升到CO2 85~90 mg/(kg·h),以后开始下降。在中华猕猴桃呼吸跃变高峰即将到来时,其果肉硬度已降至1 kg/cm2以下,果实成为可食软化状态。
图2 20℃下秦美猕猴桃的呼吸强度的变化(引自阎瑞香、刘兴华)
影响猕猴桃呼吸跃变的因素如下,不同成熟度的果实在后熟过程中都出现了呼吸跃变高峰。成熟度越高,呼吸跃变出现越早,成熟度过高的果实呼吸强度有下降的趋势。吴彬彬,饶景萍等人选用海沃德猕猴桃为试验材料,对8个不同采收期的果实进行了研究。结果证明,8个不同成熟度的果实在后熟过程中都出现了呼吸跃变高峰,成熟度越高,呼吸跃变出现越早,成熟度过高的果实呼吸强度有下降的趋势。张素酶等人对猕猴桃4个株系的果实进行了研究,结果发现不同株系间存在差异,耐贮性具有明显差异的不同品系果实,其呼吸强度也存在明显差异,耐贮品种呼吸强度低。因此,应选择呼吸强度低,跃变高峰出现迟的品种果实用于贮藏,并且应在乙烯发生量、呼吸强度大致稳定的时期采收。贮藏环境的温度对呼吸作用也会产生很大影响。在不受冷害的前提下,温度越低,呼吸越弱,一般最佳贮温为0~1℃。外源乙烯处理可使呼吸跃变提前,并提高呼吸高峰。
果实中的Ca2+含量与呼吸速率呈负相关,并且能影响呼吸速率出现的早晚进程和呼吸高峰的大小。王仁才等人研究发现,不同钙处理能不同程度地降低猕猴桃果实的呼吸强度,延长猕猴桃果实贮藏期,其中以0.5% Ca(NO3)2,+100 mg/L萘乙酸综合效果最佳。陈天等人对猕猴桃果实进行的涂膜保鲜实验发现,壳聚糖在果实表面可以形成一层半透膜,能有效减少氧气进入果实内部,显著地抑制了果实的呼吸作用。另有研究发现,在常温条件下,茶多酚可以明显降低和延迟猕猴桃果实的呼吸强度。
四、猕猴桃色素变化
猕猴桃在生长、贮藏过程中色泽的变化是关系到其品质的重要指标。猕猴桃中的主要色素是叶绿素(chlorophyll,Chl)和类胡萝卜素(carotenoid,Car)。对多个品种Chl含量的测定表明,在果实生长开始时,Chl含量是20~30 mg/g,随着果实的生长、成熟,其含量下降,到收获时下降到12~13 mg/g,其中Chl a的下降较快,Chl b下降较小;在成熟过程中,猕猴桃果实不同于其他水果,果实Chl的含量基本保持不变;在果实软熟后,Chl含量明显下降,尤其是Chl b的含量下降很快,类胡萝卜素含量基本保持不变。此外,猕猴桃果肉中单宁含量和多酚氧化酶活性低,因而猕猴桃果肉不易褐变,果实切开一段时间后仍保持其原有色泽。
任亚梅等人研究了常温和低温贮藏过程中猕猴桃果实叶绿素变化研究(见图3)。结果表明,在常温和低温贮藏过程中,各种色素含量均迅速下降,其含量下降速度快慢为Chl>Chl b>Chl a>Car。低温贮藏显著地抑制猕猴桃中各种色素的减少。低温贮藏的前15 d内,果实代谢旺盛,大部分色素迅速分解,此后各色素含量极缓慢下降,直至贮藏结束。大多数学者认为,采后果蔬变黄是因为Chl降解的速度快于Car,Chl含量与Car之比不断减少,导致Car显露出黄色引起的。任亚梅等人的在猕猴桃上研究结果也证实了这一结论。
图3 贮藏温度对猕猴桃色素的影响(引自任亚梅)
五、相关酶类的变化
果实采后伴随着一系列酶活性的变化。酶活性的异常变化将直接导致果实絮败及褐变等。目前对酶研究得比较多的是与细胞壁降解相关的酶,如果胶甲酯酶(PME)、多聚半乳糖醛酸酶(PG);与衰老相关的酶,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等。
(一)与果实软化相关的酶
在猕猴桃果实采后的软化过程中,多糖类物质,如淀粉、果胶和纤维素会发生降解,而这些物质的降解与有关水解酶活性的变化有关。目前研究最多的为淀粉酶、PME、PG、纤维素酶、半乳糖苷酶、木葡聚糖内糖基转移酶(XET)。
猕猴桃果实采后软化过程分为两个阶段:第一阶段软化较快,起主要作用的阶段性专一酶是淀粉酶;第二阶段软化较慢,起主要作用的阶段性专一酶是多聚半乳糖醛酸酶和纤维素酶。
第一阶段软化较快。猕猴桃果实富含淀粉,果实软化期间伴随着淀粉降解和淀粉酶活性上升。王贵禧等人研究表明,果实在第一阶段的硬度下降与淀粉酶活性上升所引起的淀粉快速降解显著相关(R=0.99),淀粉酶是此阶段的专一酶。
第二阶段软化较慢。杨德兴、戴京品、庞向宇等对猕猴桃果实软化过程中的PG酶活性变化研究表明,采后果实PG活性的增加与果实硬度下降呈显著的正相关关系,随着PG活性增加,果胶物质组分发生了明显变化,即总果胶和原果胶含量明显下降,而可溶性果胶含量增加。Beever和Hopkirk认为猕猴桃果实软化的主要原因之一是原果胶降解为可溶性果胶,而这种果胶降解的直接原因可能是PG活性的不断增加,因为这种PG活性的增加先于果胶多聚物降解和细胞中胶层物质的溶解。但王贵禧等人试验表明,PG活性的开始上升出现在果实软化的第二阶段,并认为PG只在果实软化的第二阶段起作用,而与软化的第一阶段无关,陈金印研究表明PG活性上升促使非水溶性果胶的降解则是导致果实第二软化阶段的主要因子,PG为果实硬度缓降期的阶段性专一酶。可见PG对猕猴桃果实软化作用有着不同结果。
果实软化期间果肉细胞壁的果胶物质先在果胶甲酯酶(PE)作用下脱酯化,溶解性上升,继而可溶性果胶在PG作用下降解,果胶脱甲酰化导致果肉细胞间黏着力下降从而造成果实第一阶段快速软化,而果胶物质的降解使得中胶层分离以及细胞可塑性增加,从而导致进一步软化。但王贵禧等人认为PE不是猕猴桃果实软化的阶段性专一酶。
木葡聚糖内糖转移酶(XET)是最近发现的一种能引起细胞壁膨胀松软,并与果实软化相关的酶。Ross等人认为该酶与猕猴桃果实软化有关。
猕猴桃果实后熟过程的果实软化第一阶段,纤维素酶活性上升缓慢,进入软化的第二阶段,其活性上升并达到高峰,同时,伴随着果实的后熟软化,纤维素含量逐渐减少,并认为纤维素酶活性上升所引起果实软化主要表现在软化第二阶段。保护性酶CA T、POD和SOD活性高峰出现在果实软化后期,因此不是果实软化的阶段性专一酶。ACC氧化酶的活性高峰出现在两个阶段之间,它所引起的乙烯释放对软化有促进作用,因此也是阶段性专一酶。
(二)与果实活性氧代谢相关的酶(https://www.xing528.com)
氧是植物生命活动所必需的,但也是活性氧产生的源泉。活性氧主要包括超氧阴离子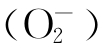 、羟自由基(·OH)、过氧化氢(H2 O2)以及单线态氧(·O2)等。植物光合电子传递链和线粒体呼吸链的电子泄漏是植物体内产生
、羟自由基(·OH)、过氧化氢(H2 O2)以及单线态氧(·O2)等。植物光合电子传递链和线粒体呼吸链的电子泄漏是植物体内产生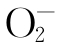 的主要来源。采后果实由于光合作用基本停止,因此
的主要来源。采后果实由于光合作用基本停止,因此 主要由呼吸链的电子泄漏产生。它们在植物衰老的氧化伤害中起着调节作用。这些活性氧自由基可以加强酶蛋白质的降解,促进脂质过氧化反应,加速乙烯产生,引发DNA损伤,改变酶的活性等,最终导致生物衰老。
主要由呼吸链的电子泄漏产生。它们在植物衰老的氧化伤害中起着调节作用。这些活性氧自由基可以加强酶蛋白质的降解,促进脂质过氧化反应,加速乙烯产生,引发DNA损伤,改变酶的活性等,最终导致生物衰老。
活性氧的清除通过活性氧清除酶系统和抗氧化物质完成。活性氧清除酶系统主要是超氧化物歧化酶(SOD)、过氧化氢酶(CA T)、抗坏血酸过氧化物酶(APX)及谷胱甘肽还原酶(GR)等。
SOD、CA T活性上升有利于清除或减轻自由基对细胞膜的破坏作用。在果实老化过程中,SOD、CA T和POD活性降低,清除自由基及过氧化物的能力减弱,自由基不断积累,攻击膜脂分子,引起过氧化作用,形成有机自由基,有机自由基一方面攻击其它脂肪酸链和蛋白质分子,另一方面自身进一步氧化为最终产物MDA等;而MDA又能反过来抑制细胞保护酶的活性、降低抗氧化物的含量,如此恶性连锁反应,直到细胞崩溃瓦解。
(三)与果实膜脂过氧化相关的酶
植物细胞膜的降解是组织衰老的主要特征之一,由于细胞内膜系统遭破坏,导致组织结构和细胞区域化的丧失,最后致使细胞内部平衡失调和功能的丧失。LOX调节组织衰老的主要机理有:(1)参与膜脂过氧化作用,导致细胞膜透性增加,促进胞内钙的积累,激活磷酸脂酶活性,加速游离脂肪酸进一步从膜脂释放,加剧细胞膜的降解。(2)膜脂过氧化产物和膜脂过氧化过程产生的游离自由基毒害细胞膜系统、蛋白质和DN A,导致细胞膜的降解和细胞功能的丧失。(3)LOX参与的膜脂过氧化作用产物可进一步生成茉莉酸和脱落酸等衰老调节因子,并参与乙烯的生物合成,促进组织衰老。陈昆松等对脂氧合酶与猕猴桃果实后熟软化的关系研究时,表明LOX启动的膜脂过氧化作用,LOX的自我活化和膜脂过氧化作用的加剧,加速了果实组织的衰老软化,即膜脂过氧化作用的启动导致了猕猴桃果实采后软化(软化的第一阶段)。LOX的活化促进了茉莉酸、脱落酸和乙烯等衰老因子的合成,进而加剧了果实的后熟软化(软化的第二阶段),果实的乙烯释放只是猕猴桃果实成熟衰老进程伴随出现的现象。
(四)与乙烯代谢相关的酶
植物体内乙烯的生物合成是以甲硫氨酸(MET)为原料,沿S—腺苷甲硫氨酸(SA M)—ACC—乙烯途径进行的。ACC是乙烯生物合成的直接前体物,它是由ACC合成酶催化而来的,又在ACC氧化酶的作用下生成乙烯,乙烯的产生直接决定于ACC氧化酶的活性及ACC的含量。王贵禧等人对猕猴桃果实乙烯代谢研究表明,在刚采收的硬果猕猴桃中,就有ACC存在,只是此时的ACC含量较低。更重要的是因为此时ACC氧化酶的活性还没有出现,因此也就没有乙烯释放。在果实采收3 d后,ACC氧化酶的活性开始出现并且快速上升,于采后10 d左右达到活性高峰,此后随着果实的进一步软化,ACC氧化酶的活性又下降,表现出了阶段性活性高峰。乙烯释放高峰出现的时间略晚于ACC氧化酶活性高峰,二者表现出极好的一致性。从ACC含量的变化看,在乙烯释放和ACC氧化酶活性快速上升直至出现高峰的整个过程中,ACC含量的上升极为缓慢,并且在乙烯释放高峰出现时,ACC的含量还略有下降,这是因为此时在ACC氧化酶的作用下将ACC快速转化为乙烯的缘故。在采后10 d,当ACC氧化酶活性下降、乙烯释放量减少时,ACC的含量才表现出了上升的趋势。
六、细胞超微结构变化
有关果实成熟软化过程中细胞壁超微结构的变化研究报道较少,一般认为果实软化的最初原因是细胞壁内部结构的破坏。果实成熟早期胞间区域细胞机械分离是由于细胞的膨大,这种作用在果实接近成熟时继续进行。
饶景萍、任小林、杨德兴等人报道猕猴桃果实在后熟初期,细胞结构完整,细胞壁中部致密,此时果实较硬;后熟中期,细胞间的中胶层和细胞壁逐渐溶解、分离,壁间产生空隙,果肉变软;接着,细胞结构进一步解体,细胞壁空隙化,胞壁中胶层液化,纤维散成一条条丝状体,继而断裂成段;果实衰老末期,果肉组织已全部崩解浆化,除能看到着色较淡的细胞膜外,细胞壁和其他结构已全部液化。
衰老叶绿体的变化有些类似于有色体发育期间结构变化,如基粒中类囊体垛叠化丧失,类囊体片层膨胀,嗜锇颗粒数目增加与体积增大。叶绿体由椭圆向圆形变化,体积缩小,超微结构呈现出一个明显有序的变化过程:类囊体膜首先松弛、膨胀、裂解,其中基质片层的变化先于基粒片层;伴随基质蛋白、核糖体等数量或叶绿体电子密度下降,嗜锇颗粒数目不变或逐渐增加,体积不断增大,整个类囊体膜片层系统逐渐裂解为泡或板;叶绿体被膜保持完整性至最后,但其外层膜裂解先于内层膜。
成熟的猕猴桃果肉细胞除了原生质膜和线粒体完整外,几乎所有的原生质结构都已解体。王仁才等人发现,采后20 d,猕猴桃果肉细胞壁胶质液化,纤维结构松散紊乱,细胞壁明显膨胀增大,细胞发生质壁分离,但细胞膜与细胞器仍完整,可明显见到细胞核、线粒体、叶绿体及液泡等,此时果实开始变软。果实始熟期前,大多数叶绿体呈纺锤形或圆形,以后有的体形伸长,有的则端部变大,可能是细胞质中颗粒进入了叶绿体所致。
七、植物激素变化
近年来,随着对果实完熟生理研究的深入,人们越来越认识到果实完熟受基因的控制,植物激素可能是完熟基因表达的启动因子,而应用植物生长调节剂则是控制果实完熟的有效手段。
许多研究表明,在五大类植物激素中,不仅是乙烯,而且其他激素如ABA、GA、IA A及CT K都从不同方面不同程度地影响果实的后熟衰老,但它们的调控机理至今尚不很清楚。
1.乙烯代谢
乙烯是一种成熟激素,在果实后熟、衰老过程中起着重要的调节作用。
有人研究发现采后完好无损的猕猴桃果实不产生乙烯,ACC氧化酶的活性也一直处于较低的水平,只有当果实受到机械伤、微生物侵染或经外源乙烯处理后,才产生乙烯。王贵禧等人研究了在不同环境条件下猕猴桃果实的乙烯代谢规律,发现刚采收的猕猴桃硬果不产生乙烯,也无ACC氧化酶活性,仅有少量ACC存在;随着果实的软化,乙烯开始出现并很快达到释放高峰;由于外源乙烯或机械伤处理促进了ACC氧化酶的活性和ACC的合成,因此加速了猕猴桃果实内源乙烯释放。
陈昆松等人的研究表明,中华猕猴桃果实和美味猕猴桃果实,在20℃后熟过程中,后熟前期虽然硬度已开始下降,但果实乙烯释放量很低。随着果实后熟进程,果实软化速度加快,乙烯开始自我催化合成大量乙烯,果实快速软化的开始与乙烯跃变的出现相一致,果实完熟时伴随出现乙烯跃变峰。可见乙烯跃变似乎是猕猴桃果实后熟进程中伴随出现的一种现象。
在猕猴桃果实采后跃变过程中的乙烯大量生成均发生在果实软化的后期,其乙烯高峰出现时,果实已达到可食成熟度,这不同于其他跃变型果实,说明乙烯可能只是一个决定猕猴桃果实后熟软化进程的因子,而非软化的启动因子。乙烯在果实成熟进程的作用主要是加速了快速软化阶段的果实软化进程,而与软化启动阶段的果实软化启动无明显关系;外源乙烯促进猕猴桃果实后熟软化的机理并不是通过促进果实内源乙烯的合成而实现的,它对果实成熟进程的调控可能只是一种间接效应。
贮藏温度的高低与乙烯释放量、释放时间相吻合。在低温下(4℃),猕猴桃果实的乙烯释放启动慢,贮藏30 d才开始启动。贮存70 d时乙烯一直处于很低水平;在15℃、25℃条件下贮藏6 d即开始乙烯释放,温度愈高乙烯高峰出现就愈早。
气调贮藏可以延缓猕猴桃果实的成熟衰老,组织内乙烯含量和乙烯生成速率明显低于对照;气调处理抑制乙烯生成的效应主要通过抑制ACC合成实现,也抑制ACC氧化酶活性,降低ACC/(ACC+MACC)的比值。
2.脱落酸
大量研究表明,ABA的含量在许多果实的发育后期有一个明显的下降过程,而在其后的果实后熟衰老过程中,ABA又有一个累积的过程,最后形成一个高峰。之后缓慢下降,与跃变型果实中乙烯的变化规律相似。
陈昆松等人的研究表明,中华猕猴桃和美味猕猴桃果实在采后初期内源ABA含量均迅速积累,并在短时间(2~4 d)内达到最大值,之后快速下降,在ABA的下降过程中,果实后熟进程加快,乙烯进入跃变上升期,即ABA积累出现在果实后熟前期,而乙烯跃变发生在果实后熟中后期,且两种猕猴桃品种的这种变化一致;外源ABA处理可增加内源ABA的积累,并加快了内源IA A降解,加速果实的后熟软化;Ca2+处理可有效地延缓猕猴桃果实的后熟软化,但Ca2+处理对猕猴桃果实软化的效果不是通过影响ACC氧化酶活性和乙烯生成来实现的,Ca2+处理可明显抑制猕猴桃果实内源ABA水平的增加,进而延缓果实软化。
ABA对果实后熟衰老进程的调控方式可能是直接促进水解酶活性增加,参与了猕猴桃果实成熟过程的软化启动过程,并通过刺激乙烯生成间接对成熟过程的果实软化起促进作用。所以,在猕猴桃果实的后熟软化进程中,ABA可能参与了果实软化的启动过程,乙烯则对后熟软化速率起主导作用,而抑制成熟衰老激素如IA A等的急剧下降,则是实现ABA和乙烯等成熟衰老激素促进成熟衰老的前提条件之一。
3.生长素IA A
生长素IA A是生长类激素,对果实的后熟衰老有抑制作用。许多研究证实,在果实的后熟进程中,完熟前IA A的含量持续下降,直至最低水平。
陈昆松等人测得猕猴桃果实采后内源IA A的含量随着后熟进程呈显著下降趋势,随着IA A水平的不断下降,出现乙烯跃变峰。这说明,果实成熟过程内源IA A水平的下降,是果实成熟衰老的前提条件之一。
4.赤霉素GA
赤霉素GA的含量在果实的后熟衰老过程中持续下降,因而也被认为是一类抑制果实完熟的植物激素。阮晓等认为相对生长发育期间高水平GA 3,采后GA 3骤减至低水平是果实成熟的必要条件。
5.细胞分裂素
目前,有关CT K在果实后熟衰老过程中的变化动态研究的还不多,但也有研究认为,细胞分裂素同赤霉素一样具有延迟果实成熟和衰老的作用,在果实贮藏过程中,CT K的含量也呈逐渐降低的趋势。
植物激素对果实后熟软化进程的调控是一个比较复杂的过程,该过程不仅仅取决于某一种激素的消长和其绝对浓度的变化,内源激素间的相互平衡及相互间的协同作用也显得更为重要。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




