一、疑难问题
痴呆发病的真正原因十分复杂,而且涉及多种病理机制与病理过程,目前的研究资料尚未完全阐明。但据当今报道,其发病因素已涉及60余种。
二、专家点评
(一)痴呆的病因目前尚未十分明确
痴呆是因不同疾病引起脑功能障碍而产生的智能损害综合征。根据其病因主要分为脑变性疾病引起的痴呆——阿尔茨海默病性痴呆、脑血管病引起的痴呆、混合型痴呆3大类。
常见的发病因素大致有脑血管疾病、中枢神经系统变性病、炎症、肿瘤、内分泌失调、营养不良、代谢障碍、中毒等全身性疾病,以及年龄增长、钙离子含量过低、丧偶、文盲与贫穷、抑郁、独居等。
近年国外大量研究的重点集中在:遗传学、免疫学、病毒感染、神经递质和神经内分泌等方面,表明许多因素与该病病因有关。
1.脑变性疾病 脑变性疾病引起的痴呆有许多种,最为多见的是阿尔茨海默病性痴呆,在老年前期发病的又叫做早老性痴呆。其发病缓慢,为逐渐进展的进行性痴呆。除此之外,还有额颞叶痴呆(frontotemporal dementia,FTD)、皮克病、亨廷顿舞蹈症性痴呆、进行性核上性麻痹、帕金森病性痴呆等等。
在临床工作中,痴呆患者家属往往反映其“记性不好”,采集病史时应注意询问FTD特征性行为和语言症状,神经心理学检查可以鉴定FTD相关认知损害的领域,而最终结构和功能影像学发现额叶、颞叶特征性改变是诊断FTD的重要依据。对FTD了解程度的加深有助于获得早期诊断,并鉴别于其他类型的痴呆。
2.脑血管病 最常见的有多发性脑梗死性痴呆,是由于一系列多次的轻微脑缺血发作,多次积累造成脑实质性梗死所引起。此外,还有皮质下血管性痴呆、急性发作性脑血管性痴呆,可以在一系列脑出血、脑栓塞引起的脑卒中之后迅速发展成痴呆,少数也可由一次大面积的脑梗死引起。总之,脑血管病也是老年痴呆较为常见的病因。
3.遗传因素 国内外许多研究都证明,老年痴呆患者的后代有更多机会患上此病。但是,其遗传方式目前仍不清楚。有人认为是显性基因遗传;有人则认为是隐性基因遗传;也有人认为是多基因常染色体隐性遗传,且遗传作用可受环境因素和遗传因子的突变所制约,以致中断其遗传作用。也有一些研究认为老年痴呆属非遗传性疾病,如血管性痴呆与遗传无直接关系。
4.内分泌疾病 如甲状腺功能减退症和副甲状腺功能减退症都可能引起痴呆。
5.营养及代谢障碍 由于营养及代谢障碍造成了脑组织及其功能受损而导致痴呆。如各种脏器引起的脑病,像肾性脑病,是慢性肾衰竭、尿毒症引起脑的缺血、缺氧,可以导致痴呆;其他如肝性脑病、肺性脑病等都可导致痴呆。营养严重缺乏,如维生素B1、维生素B12以及烟酸、叶酸缺乏症均可导致痴呆。糖尿病及高脂血症都可引起大、中动脉血管发生动脉粥样硬化,小血管及微血管基底膜增厚,可引起脑梗死及脑出血,导致血管性痴呆。自20世纪90年代,国外许多研究开始关注糖尿病与痴呆之间的相关性及糖尿病患者中痴呆患病率的情况。Bruce等研究223例糖尿病患者中痴呆患病率70—74岁组为7.2%,75—79岁组为20.8%,80岁以上组为27.5%。荷兰Ott等研究724例糖尿病者中痴呆的患病率为8.1%。上海复旦大学附属华山医院神经内科研究糖尿病组痴呆患病率[4.75%(23/484),95%CI:3.03%~7.04%]高于非糖尿病组[2.24%(11/490),95%CI:1.13%~3.98%]差异具有统计学意义(x2=4.54,P<0.05)。糖尿病组中有高血压及脑卒中史的患者痴呆患病率为11.5%(9/78),高于非糖尿病组中相应患者的痴呆患病率1.9%(1/53)。
6.肿瘤 恶性肿瘤引起代谢紊乱可导致痴呆,脑肿瘤也可直接损伤脑组织导致痴呆。
7.药物及其他物质中毒 酗酒、慢性洒精中毒者引起的老年痴呆并不少见。长期接触铝、汞、金、银、砷及铅等,防护不善,引起慢性中毒后可以导致痴呆。一氧化碳中毒也是常见的导致急性痴呆的原因之一。
8.艾滋病 艾滋病是导致老年痴呆的原因之一。目前已知老年人患艾滋病早期即可出现进行性痴呆,并已证明是中枢神经系统可以直接感染人免疫缺陷病毒(HIV)。
9.梅毒 梅毒螺旋体可以侵犯大脑,产生精神和神经症状,最后导致麻痹以及日益加重的智力减退和个性变化,即所谓的麻痹性痴呆。
10.其他 脑外伤、癫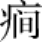 的持续发作,以及正常压力脑积水等原因均可引起老年痴呆。此外,老年人长期情绪抑郁、离群独居、丧偶、文盲、低语言水平、缺乏体力及脑力锻炼等,也可加快脑衰老的进程,诱发老年痴呆。(https://www.xing528.com)
的持续发作,以及正常压力脑积水等原因均可引起老年痴呆。此外,老年人长期情绪抑郁、离群独居、丧偶、文盲、低语言水平、缺乏体力及脑力锻炼等,也可加快脑衰老的进程,诱发老年痴呆。(https://www.xing528.com)
(二)老年痴呆病因众多
大多数专家普遍认为,引起老年痴呆病因众多,难以用一种原因解释,可能是多种因素相互作用的结果。
年龄是引起老年痴呆的一个最危险因素;其次是遗传因素,老年痴呆者近亲的发病率为一般人群的4倍多;再次还有微量元素的影响,如铝、铁、锌、硒等,环境中铝的含量过高与痴呆的发病率、死亡率有关;也有人认为脑外伤、中毒、代谢、内分泌疾病、维生素缺乏等因素均可影响痴呆的发生。另外研究结果证实,老年痴呆可能还与脑部慢性缺血、缺氧有关。美国匹兹堡大学医学院TifanyE Hughes及其同事在Neurology杂志上报告,在基线时体重指数(BMI)较低或在晚年BMI较快下降都预示着有可能发展为痴呆性疾病。
因此,社会各界应关心不同层面老年人的晚年生活,创造更多的交流、活动的机会,让更多的老年人老有所为、老有所乐,延缓老年痴呆的发生。
(三)阿尔茨海默病的病因
大多数学者研究认为,阿尔茨海默病的病因可能与以下因素有关。①遗传假说:AD具有家族聚集性,呈常染色体显性遗传及多基因遗传。研究发现,70岁以下发病有血缘关系的SDAT,占84岁以前痴呆的45%,但只有10%的患者在70岁以前出现症状,提示在这些家庭中有这种疾病的存在。有人在流行病学调查和家庭研究中发现了SDAT的高发家族,单卵双生子中既有SDAT同病者,也有非同病者,提示遗传因素在老年痴呆病因中的重要作用。②慢病毒假说。③AD患者的胆碱乙酰转移酶水平显著降低,有人推测与胆碱功能低下有关。④免疫假说:老年人随着年龄增长AD发病率明显增高。随着年龄的增长,其免疫系统功能减退,自身免疫性疾病亦增加。⑤有人发现AD患者脑中的铝含量较高,所以有铝中毒假说。⑥其他危险因素:AD的发生与年龄、性别、种族、脑外伤史(拳击性痴呆)、疾病史、社会心理因素、人格等有关系。其中与年龄的关系比较密切。
(四)血管性痴呆的病因与危险因素
1.血管性痴呆的病因 根据血管性痴呆的病因,可分为以下几种。①多发性脑梗死性痴呆:指当梗死体积超过80~150ml时多出现痴呆症状;②单发主要部位的脑梗死性痴呆:梗死灶所在的部位比梗死灶的总体积更主要,常见于大脑后动脉供血区、角回尾状核等区域;③多发腔隙性脑梗死引起的痴呆:目前认为脑微小动脉病变所引起的腔隙状态是血管性痴呆的主要原因,占血管性痴呆发病的50%以上;④脑低灌注引起的痴呆;⑤出血性脑血管病引起的痴呆;⑥其他原因引起的痴呆。
2.血管性痴呆的危险因素 包括以下几种。①动脉硬化:如高血压、糖尿病、高血脂、肥胖、吸烟、高盐饮食、高凝状态、心脏病、饮酒等可促使动脉粥样硬化的加速,易引起卒中而致血管性痴呆;②慢性脑灌注不足:研究发现,在血管性痴呆患者出现痴呆症状的前两年即有弥漫性脑血流量下降,慢性脑灌注不足被认为是皮质下血管性痴呆的一个重要危险因素;③年龄与性别:血管性痴呆多见于男性,且发病率随年龄的增长而增加;④遗传因素:研究发现,芳香硫酸酯酶假性缺陷基因(ASA-PD)可能与血管性痴呆的发病有关;⑤受教育程度:大多数报道认为血管性痴呆的发病率随着受教育程度的升高而下降,也有少数学者认为血管性痴呆的发病率与受教育程度无关。
(五)老年痴呆的发病机制及策略
老年痴呆可以是阿尔茨海默病、血管性痴呆和二者并存的混合型痴呆。老年期痴呆病患病率55岁及以上者为4.6%,65岁及以上者为7.3%。AD较VD更常见,类似于西方白人。无论AD还是VD,均以农村患病率高于城市,AD的平均发病年龄76岁晚于VD约10年,女性多于男性,VD则男性多于女性。AD的病程可以延续20年,早期或轻度阶段为9年,中期或中等程度为5年,晚期或严重阶段约6年。本病要经历两种死亡,首先是精神上的死亡,然后是肉体上的死亡,给个人、家庭和社会带来沉重负担。本病在西方国家是导致死亡的第4位原因,仅次于心脏病、肿瘤和卒中。
1.AD相关基因突变和多型性 至少已发现4种基因或多型性与AD有关,即21号染色体的淀粉样蛋白前体(APP)基因;14号染色体的早老素(PS或称STM)1基因(PS-1);1号染色体的早老素2基因(PS-2)和19号染色体的载脂蛋白E(APOE)4基因。APP、PS-1、PS-2基因与早发型家族性AD有关,早发型家族性AD患者至少有其中之一的异常。APOE基因与迟发型家族性AD有关,与散发性AD也有一定关系。PS-1和APOE4基因缺陷在散发性AD较常见。
2.神经细胞钙稳态失调和自由基代谢异常 细胞内钙和自由基是神经元损伤、死亡的关键因素。现趋向于认为,它们是急性和慢性神经退行性病致细胞死亡的“最后共同通路”(final common pathways)。神经细胞的死亡有两种形式,即细胞凋亡和细胞坏死,前者主要是“死亡基因”表达增加所致,后者来自不可控制的大量离子内流和细胞溶解。现已确定,死亡基因的表达增加或大量离子内流入细胞,其元凶仍然是钙稳态失调和自由基的形成过多。什么情况下出现凋亡或坏死,决定于损伤的程度和持续时间,而非损伤的性质。反过来,各种基因的、环境的因素都会影响神经元的钙稳态和自由基代谢,破坏钙稳态致胞内钙超载的因素包括兴奋性毒、能量利用减少和Aβ的作用。谷氨酸和能量供应不足导致ROS如超氧阴离子、过氧化氢和NO的大量产生。另一方面,Aβ诱导的ROS似是发生在胞内钙升高之前的主要事件,胞内钙超载和ROS的形成会造成蛋白质、脂质和DNA的损伤,最后引起细胞死亡。由Aβ引起的亚毒性水平的膜氧化能损伤受体的耦联,如AChR对GTP-结合蛋白的耦联。
3.AD与细胞凋亡 AD的主要特征之一是神经元的丢失,已如前述。Aβ的神经毒性主要表现在细胞凋亡。细胞凋亡又称细胞程序性死亡(PCD),分为以下几个步骤:①凋亡激活信号(ap-optosis activation signal);②启动(initiation);③承诺(commitment);④执行(execution);⑤清除(elimination)。细胞凋亡的主要调控因素有:①钙稳态失调、自由基、兴奋性毒性、线粒体功能障碍;②凋亡相关基因启动和表达;③参与细胞凋亡的酶——蛋白酶、蛋白激酶、核酸内切酶;④细胞因子。有些细胞因子诱导PCD,有些细胞因子抑制PCD。主要有细胞介素、集落刺激因子(CSF)、肿瘤坏死因子(TNF)、转化生长因子(GFG)、神经营养因子等;⑤细胞周期中Cyclin表达增加,CDK(Cyclin-依赖性激酶)被激活,进而诱导促凋亡基因的表达。
4.线粒体损伤与AD 生物能量代谢包括能量的合成代谢、利用代谢。它是机体维持正常生理功能所需。一旦此代谢失衡,可导致疾病的发生或疾病恶化。脑只占人体重量的2%,但却是一高耗能组织,对血流量和氧的需求占全身总量的20%和25%。无疑,老年痴呆的发病与生物能量代谢的关系十分密切。
(李 玲)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




