内皮细胞在血流产生的剪切应力及其他一系列受体激活作用下释放出NO,最初一度被称作内皮源性舒张因子。NO由一氧化氮合酶(nitric oxide synthase,NOS)在氧(O2,oxygen)、四氢生物蝶呤(tetrahydrobiopterin,BH4)及还原型尼克酰胺二磷腺苷(NADPH)这些辅因子存在的条件下催化底物L-精氨酸(L-arginine)产生。L-瓜氨酸(L-Citrulline)为催化过程的副产物。可被NOS识别的假底物,如NG-单甲基-精氨酸(NG-monomethyl-arginine),可以通过底物竞争作用抑制L-精氨酸转化为NO。NO为高度活跃的自由气体,在体内的半衰期仅有数秒钟,且易透过生物膜。NO由内皮向血管平滑肌细胞弥散后,可以升高后者胞质内环鸟氨酸(cGMP)的浓度,引起平滑肌的松弛(图4-1)。
(一)NO在循环系统的作用
由于内皮细胞可以持续地释放基础水平的NO,从而影响了外周动脉血管的基础张力。故全身性的抑制一氧化氮合酶(NOS)的活性可以导致动脉压增高。与内皮功能相关的NOS有两种类型:一是存在于内皮细胞内的固有亚型,故称内皮NOS(endothelial NOS,eNOS,NOS3);二是诱导亚型,为巨噬细胞在免疫刺激作用下释放的重要炎症介质(inducible NOS,iNOS,NOS2)。另外一种固有亚型神经元型NOS(Neuronal NOS,nNOS,NOS1)目前发现存在心室肌细胞的肌浆网,暂未发现在内皮有表达。NO除了有舒张血管作用以外,还具有抗栓、抗增殖、抑制白细胞黏附作用,并且可影响心肌的收缩力。通过药物抑制NO产生可产生体循环及肺循环动脉压增高和心输出量下降的血流动力学效应。
(二)内皮细胞膜及细胞信号传导
血管内皮细胞的离子通道在控制内皮细胞静息电位及控制内皮细胞向平滑肌细胞的信号传导方面发挥重要的作用,因而这些离子通道的活动是血流的主要决定因素。通道的活性受到血管舒张因子、血流产生的机械力和局部代谢状态等因素影响。
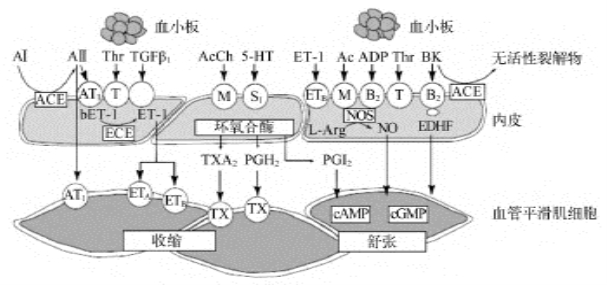
图4-1 内皮源性血管活性物质(https://www.xing528.com)
bET-1:big ET1.内表皮-1前体;NOS.一氧化合酶;cAMP环磷腺苷;cGMP环磷鸟苷;Tx血栓烷素受体
内皮细胞在血流产生的剪切应力及其他一系列受体激活作用下释放出NO。NO作用于平滑肌细胞发挥血管舒张和抗增殖作用,也能抑制血小板聚集和白细胞黏附。内皮素-1(ET-1)经激活血管平滑肌上的ETA受体产生血管收缩效应和促进细胞增殖。相反,内皮ETB受体则介导NO和前列环素的血管舒张效应。ACE.血管紧张素转化酶;Ach.乙酰胆碱;ADP.二磷腺苷;AⅡ.血管紧张素Ⅱ;AT1.血管紧张素1型受体;BK.缓激肽;B2.缓激肽受体2;COX.环氧化酶;ECE.内皮素转化酶;EDHF.内皮源性超极化因子;ETA和ETB.内皮素A型和内皮素B型受体;ET-1.内皮素-1;L-Arg.L-精氨酸;M.毒蕈碱受体;PGH2.前列腺素H2;PGI2.前列环素I2;S.血清素受体;Thr.凝血酶;T.血栓烷素受体;TXA2.血栓烷素A2;5-HT.5-羟色胺(Battegay EJ 2005)
完整动脉内皮细胞的静息电位为-40~-60mV,而完整静脉内皮细胞和培养内皮细胞的静息电位则更低些。内皮细胞属于非兴奋细胞,不能产生动作电位。
内皮细胞与内皮细胞之间通过缝隙连接和紧密连接保持电学偶联。这些连接的紧密程度也决定了血管内皮对代谢产物的细胞间通透性。发生于内皮细胞间的离子转运比跨内皮细胞的离子转运更为重要,因而内皮细胞及内皮下肌细胞之间的缝隙连接构成一重要的信号转导通路。
血管张力的改变可激活机械敏感性离子通道。在某些物种或血管床,产生内向的去极化电流。同样的血流产生的剪切应力可以激活内向整流的钙离子激活的钾通道(外向电流)。血流介导激活这些离子通道引起细胞超极化和NO的释放。
相似地,舒血管物质(如乙酰胆碱、缓激肽、P物质、三磷腺苷、腺苷和组胺)均可使内皮细胞产生外向电流和超极化。介导这一过程的钙离子激活的钾通道主要有两种,分别是高电导的缓激肽通道和低电导的SK通道。代谢因素如低氧血症,可以通过ATP敏感性钾通道影响内皮细胞的跨膜电位。该离子通道可被磺脲类药物(如格列苯脲)阻断。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




